Paciente do sexo masculino, 58 anos de idade, negro, hipertenso controlado com medicamentos e ex-etilista. Procurou o Pronto-Socorro do Hospital do Servidor Público Estadual de São Paulo (IAMSPE) com história de dor epigástrica há três dias, evoluindo com icterícia, colúria e náuseas há um dia. Negava febre, alteração intestinal ou perda ponderal. Encontrava-se orientado, corado, hidratado, ictérico ++/4+, normocárdico e afebril, com abdome flácido, discretamente doloroso à palapção profunda da região epigástrica, sem massas palpáveis. Enzimas canaliculares e bilirrubina, à custa de direta, aumentadas, transaminases discretamente elevadas e hemograma normal. Foi submetido a exames de imagem e internado no Serviço de Cirurgia Geral Avançada e Oncológica do IAMSPE.
Descrição das imagens
Figura 1. A,B,C: Tomografia computadorizada do abdome, sem contraste (
A), arterial (
B) e equilíbrio (
C). Observar lesão sólida de aproximadamente 2,5 cm logo acima da bifurcação do ramo esquerdo da veia porta, associada a importante componente cístico complexo com realce periférico melhor identificado na fase de equilíbrio.
D,E,F: Ressonância magnética do abdome, T1 sem contraste ou saturação de gordura (
D), T2 com supressão de gordura (
E) e T1 com gadolínio na fase de equilíbrio (
F). Correlacionar as sequências de TR curto (
D) e longo (
E), em que foi possível diferenciar a formação sólida da cística. A lesão sólida possui sinal intermediário em T1 e alto no T2, porém menos intenso que o líquido e a lesão cística (acúmulo de mucina e bile), que possuem sinal baixo no T1 e alto no T2. No estudo com contraste (
F) é possível identificar o realce da porção sólida e da periferia da porção cística, além da dilatação das vias biliares intra-hepáticas.
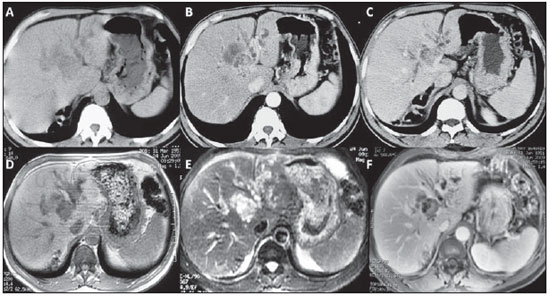
Figura 1. A,B,C: Tomografia computadorizada do abdome. D,E,F: Ressonância magnética do abdome.
Ressonância magnética do abdome.
B: Colangio-RM. Associando o estudo do fígado no plano coronal com gadolínio e o estudo das vias biliares, foi possível identificar e topografar corretamente a lesão, que ocupava o segmento IV e parte do VIII. Observar um linfonodo de aproximadamente 2 cm promovendo compressão extrínseca do ducto hepático comum. Existe dilatação das vias biliares intra-hepáticas, principalmente dos ramos esquerdos.
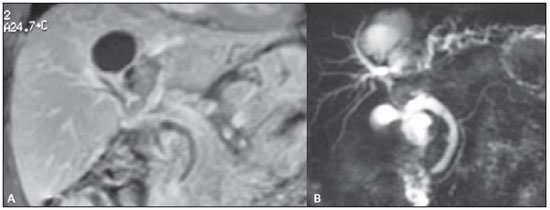
Figura 2. A: Ressonância magnética do abdome. B: Colangio-RM.
Neoplasia intraductal papilífera mucinosa de via biliar (IPMN-b) intra-hepática.
COMENTÁRIOS
Os colangiocarcinomas podem ser divididos em extra-hepáticos e intra-hepáticos. Os intra-hepáticos são subdivididos em nodulares ou exofíticos, infiltrativos ou esclerosantes (periductais), e intraductais ou polipoides, sendo o IPMN-b um tipo de colangiocarcinoma intra-hepático intraductal. Eles seguem a mesma sequência de diferenciação tumoral: adenoma – carcinoma
in situ – adenocarcinoma(1).
Os IPMNs podem ser císticos e não císticos e subdivididos em quatro tipos: 1) pancreatobiliar; 2) gástrico (menos agressivo); 3) intestinal (pior prognóstico); 4) oncocítico. Uma das principais características é a mucina intraductal (mucobilia). Além disso, apresentam-se como massas sólido-císticas (mais de 50% císticas), com epitélio colunar contendo mucina, ausência de estroma ovariano e imuno-histoquímica positiva para MUC2, entre outras(2,3).
A idade média é de 58,9 (41–76) anos, semelhante em ambos os sexos. Podem causar sintomas inespecíficos, como dores no hipocôndrio direito, icterícia, colangite, ou serem assintomáticos. Os marcadores tumorais podem ou não estar alterados, principalmente CEA e Ca 19-9(3–9).
Tumores papilíferos dos ductos biliares intra-hepáticos são caracterizados por crescimento intraluminal, algumas vezes como massa papilar associada a obstrução de ducto biliar e dilatação a montante. Os tumores papilares geralmente produzem uma grande quantidade de mucina devido ao acúmulo e crescimento da lesão cística, promovendo obstrução do fluxo biliar e levando a icterícia e importante dilatação das vias biliares. O IPMN-b é um tipo de tumor recentemente reconhecido e descrito em associação com microlitíase biliar intra-hepática, em que a histopatologia se correlaciona com o IPMN-p (do pâncreas), devido à excessiva produção de mucina(4).
Os ductos biliares que contêm o tumor papilífero intraductal mucinoso podem estar dilatados difusamente ou focalmente simulando um aneurisma. A dilatação lobar desproporcional – tipo aneurismática – dos ductos biliares, quando comparada com o lobo contralateral normal, é um sinal característico da presença de tumor intraductal. Os estudos de Lim et al.(1,10–13) foram os mais importantes na descrição e demonstração deste sinal típico e da melhor caracterização deste raro tumor.
A ressonância magnética com estudo dinâmico utilizando o gadolínio, associada à colangio-RM, é o melhor método não invasivo para caracterização deste tipo de tumor. No entanto, a tomografia computadorizada
multislice com estudo dinâmico associada ao estudo invasivo da via biliar, seja colangiopancreatografia retrógrada ou colangiografia transparieto-hepática, também podem ser de grande valia(10,12,14).
O tratamento para esses tumores é exclusivamente cirúrgico. O prognóstico é favorável, comparado com as neoplasias biliares não papilíferas. É uma boa indicação de ressecções agressivas, independentemente do tamanho do tumor. A recidiva é rara, desde que o tumor ressecado tenha margens livres ao exame anatomopatológico(5,7).
Sobre o paciente e o tratamento
O paciente evoluiu com piora da icterícia e colangite, tendo sido submetido a colangiografia transparieto-hepática que evidenciou obstrução ao nível da bifurcação e falha de enchimento intraductal. O paciente ficou com drenagem externa e interna. Após resolução da colangite, foi submetido a exploração cirúrgica, já que os exames de imagem comprovaram doença localizada e ressecável. O paciente foi submetido a ressecção hepática esquerda ampliada – segmentos II, III, IV, V e VIII (Figura 3).
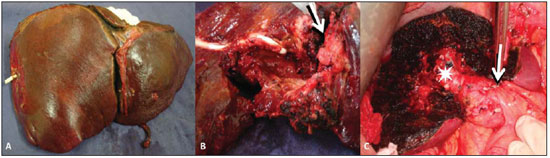
Figura 3. A: Peça cirúrgica demonstrando a hepatectomia esquerda regrada (segmentos II, III e IV) associada a segmentectomia dos segmentos V e VIII. B: Aspecto macroscópico da lesão sólida (seta) e da formação cística com paredes infiltradas, em que se identifica o dreno. C: Imagem intra-operatória do fígado remanescente demonstrando os segmentos VI e VII, o ramo portal direito posterior (asterisco) e a secção/ligadura do ramo portal esquerdo (seta).
O diagnóstico definitivo baseado apenas nos achados de imagem é difícil e não foi realizado no presente caso. O resultado final foi realizado somente após ressecção cirúrgica e estudo imuno-histoquímico, comprovando-se ser IPMN-b, com margens livres. O paciente segue bem e em acompanhamento ambulatorial.
Considerações finais
O presente relato demonstra a importância da avaliação multidisciplinar e a discussão conjunta entre cirurgião, radiologista e oncologista para possibilitar a melhor decisão terapêutica para o paciente.
REFERÊNCIAS
1. Lim JH. Cholangiocarcinoma: morphologic classification according to growth pattern and imaging findings. AJR Am J Roentgenol. 2003;181:819–27.
2. Choi SC, Lee JK, Jung JH, et al. The clinicopathological features of biliary intraductal papillary neoplasms according to the location of tumors. J Gastroenterol Hepatol. 2010;25:725–30.
3. Yaman B, Nart D, Yilmaz F, et al. Biliary intraductal papillary mucinous neoplasia: three case reports. Virchows Arch. 2009;454:589–94.
4. Carrafiello G, Bertolotti E, Sessa F, et al. Intraductal papillary mucinous tumor of bile ducts radiologic and pathologic features: a case report. Cases J. 2008;1:319.
5. Li T, Ji Y, Zhi XT, et al. A comparison of hepatic mucinous cystic neoplasms with biliary intraductal papillary neoplasms. Clin Gastroenterol Hepatol. 2009;7:586–93.
6. Nakanuma Y. A novel approach to biliary tract pathology based on similarities to pancreatic counterparts: is the biliary tract an incomplete pancreas? Pathol Int. 2010;60:419–29.
7. Paik KY, Heo JS, Choi SH, et al. Intraductal papillary neoplasm of the bile ducts: the clinical features and surgical outcome of 25 cases. J Surg Oncol. 2008;97:508–12.
8. Xu J, Sato Y, Harada K, et al. Intraductal papillary neoplasm of the bile duct in liver cirrhosis with hepatocellular carcinoma. World J Gastroenterol. 2011;17:1923–6.
9. Zen Y, Pedica F, Patcha VR, et al. Mucinous cystic neoplasms of the liver: a clinicopathological study and comparison with intraductal papillary neoplasms of the bile duct. Mod Pathol. 2011. [Epub ahead of print].
10. Lim JH, Yoon KH, Kim SH, et al. Intraductal papillary mucinous tumor of the bile ducts. Radiographics. 2004;24:53–67.
11. Lim JH, Park CK. Pathology of cholangiocarcinoma. Abdom Imaging. 2004;29:540–7.
12. Lim JH, Jang KT, Choi D. Biliary intraductal papillary-mucinous neoplasm manifesting only as dilatation of the hepatic lobar or segmental bile ducts: imaging features in six patients. AJR Am J Roentgenol. 2008;191:778–82.
13. Lim JH. Cholangiocarcinoma: recent advances in imaging and intervention. Abdom Imaging. 2004;29:538–9.
14. Lee NK, Kim S, Lee JW, et al. MR appearance of normal and abnormal bile: correlation with imaging and endoscopic finding. Eur J Radiol. 2010;76:211–21.
1.
Fellowship em Cirurgia Oncológica pela Johns Hopkins School of Medicine, Baltimore, MD, EUA, Residência Médica em Cirurgia Geral Avançada pelo Hospital do Servidor Público Estadual de São Paulo (IAMSPE), São Paulo, SP, Brasil.
2. Cirurgião Preceptor do Hospital do Servidor Público Estadual de São Paulo (IAMSPE), São Paulo, SP, Brasil.
3. Chefe do Serviço de Cirurgia Geral e Avançada do Hospital do Servidor Público Estadual de São Paulo (IAMSPE), São Paulo, SP, Brasil.
4. Residência Médica em Cirurgia Geral Avançada pelo Hospital do Servidor Público Estadual de São Paulo (IAMSPE), São Paulo, SP, Brasil.
5. Professor Associado da Disciplina de Cirurgia do Aparelho Digestivo do Departamento de Gastroenterologia da Faculdade de Medicina da Universidade de São Paulo (FMUSP), São Paulo, SP, Brasil.
6. Doutor, Professor de Radiologia da Universidade Federal Fluminense (UFF), Niterói, RJ, Brasil.
Endereço para correspondência:
Dr. Marcelo Souto Nacif
4853 Cordell Avenue apt 419
Bethesda, MD. 20814, USA
E-mail: msnacif@yahoo.com.br / www.msnacif.med.br
Trabalho realizado no Serviço de Cirurgia Geral e Oncológica do Hospital do Servidor Público Estadual de São Paulo (IAMSPE), São Paulo, SP, em conjunto com o Departamento de Radiologia da Universidade Federal Fluminense (UFF), Niterói, RJ, Brasil.
 Vol. 44 nº 3 - Maio / Jun. of 2011
Vol. 44 nº 3 - Maio / Jun. of 2011


