Radiologia Brasileira - Publicação Científica Oficial do Colégio Brasileiro de Radiologia
AMB - Associação Médica Brasileira CNA - Comissão Nacional de Acreditação
 Vol. 48 nº 2 - Mar. / Abr. of 2015
Vol. 48 nº 2 - Mar. / Abr. of 2015
|
ARTIGO ORIGINAL
|
|
|
|
|
Autho(rs): Ricardo Hoelz de Oliveira Barros1; Thiago José Penachim1; Daniel Lahan Martins1; Nelson Adami Andreollo2; Nelson Marcio Gomes Caserta3 |
|
|
Descritores: Câncer gástrico; Tomografia computadorizada; Estadiamento. |
|
|
Resumo: INTRODUÇÃO
O câncer gástrico é, atualmente, a quarta neoplasia mais comum no mundo, apesar de relatos de queda na incidência em países desenvolvidos. Mantém altas taxas de mortalidade, permanecendo como a segunda causa de morte relacionada ao câncer no mundo, apenas atrás do câncer de pulmão(1). O subtipo histológico mais frequente é o adenocarcinoma, compreendendo cerca de 95% dos casos. Os demais são compostos por linfomas, tumores de origem estromal e outros mais raros, como neuroendócrinos. A sobrevida está relacionada à profundidade de invasão tumoral e ao acometimento linfonodal. A sobrevida em cinco anos de tumores avançados varia entre 7% e 27%, enquanto a de tumores precoces chega a 85-100%(2). Alguns tumores precoces (T1) podem ser passíveis de ressecção endoscópica (mucosectomia) ou laparoscópica. Por outro lado, alguns protocolos indicam quimioterapia e/ou radioterapia neoadjuvantes em casos de câncer gástrico avançado(3). Assim, a definição da terapia apropriada a cada paciente depende de um estadiamento pré-operatório acurado e pode ajudar a aumentar as taxas de cura e de qualidade de vida. O sistema TNM (tumor/node/metastasis) é o meio mais utilizado de se estadiar o câncer, estando já em sua sétima edição(4,5). O estadiamento pré-operatório frequentemente é realizado com ultrassonografia abdominal, tomografia computadorizada e ultrassonografia endoscópica(6). Até recentemente, a ultrassonografia endoscópica era considerada como o melhor método para estadiamento pré-operatório do grau de invasão tumoral (categoria T)(7). Os consensos internacionais mais recentes ratificaram a necessidade de se realizar o estadiamento TNM pré-operatório e elegeram como melhor método a tomografia computadorizada com múltiplos canais de detectores(8,9), que vem demonstrando acurácia similar ou superior à ultrassonografia endoscópica no estadiamento T e clara vantagem em relação aos outros métodos nas categorias N e M. A tomografia computadorizada com multidetectores, especialmente nos aparelhos com 16 ou mais canais, oferece rápida aquisição com secções submilimétricas, reconstruções multiplanares isotrópicas e opções de pós-processamento como a gastroscopia endoscópica virtual, que aumentam a acurácia do método no estadiamento local(10-13). Além disso, a tomografia oferece a capacidade de avaliação linfonodal e de outros órgãos(14). Ainda não foi demonstrada vantagem significativa da ressonância magnética sobre a tomografia computadorizada no estadiamento do câncer gástrico(15-17). Há poucos trabalhos na literatura quantificando a performance diagnóstica da tomografia computadorizada com 64 fileiras de detectores no estadiamento pré-operatório do câncer gástrico, e a literatura nacional é particularmente pobre neste quesito. O objetivo deste trabalho foi o de avaliar o papel da tomografia computadorizada de múltiplos detectores no estadiamento local pré-operatório do adenocarcinoma gástrico, com determinação da sensibilidade, especificidade e acurácia para cada categoria T, N e M, bem como a acurácia global para cada uma destas categorias. MATERIAIS E MÉTODOS Entre junho de 2009 e julho de 2011, 54 pacientes com adenocarcinoma gástrico, comprovados por biópsia endoscópica, ainda não tratados por cirurgia, quimioterapia ou radioterapia, foram avaliados de forma prospectiva e préoperatória por tomografia computadorizada de múltiplos detectores. Destes, quatro foram excluídos por não terem sido submetidos a laparotomia - todos porque apresentavam doença metastática e sem necessidade de cirurgia paliativa no momento da avaliação clínica inicial. Dos 50 pacientes restantes, 22 (44%) eram do sexo feminino e 28 (56%) do sexo masculino. Na época da cirurgia, a idade dos pacientes variou entre 33 e 88 anos, com idade média de 61,6 anos. Apenas casos de adenocarcinoma foram considerados neste estudo, e outras lesões neoplásicas, tais como linfomas, foram excluídas. Protocolo do exame de tomografia computadorizada Os exames de tomografia computadorizada foram realizados em aparelho com 64 canais de detectores (Aquillion 64; Toshiba Medical Systems, Tochigi, Japão), em pacientes com jejum prévio mínimo de oito horas. Os pacientes foram informados sobre o procedimento e o termo de consentimento informado foi obtido. Inicialmente, os pacientes ingeriram 750 mL a 1.000 mL de água, em 10 a 15 minutos, visando à distensão gástrica adequada. Uma aquisição volumétrica do abdome superior foi então realizada, antes da administração do meio de contraste iodado por via venosa. Todos os pacientes realizaram o exame em posição supina. A seguir, foram realizadas aquisições volumétricas do abdome superior em fase arterial, do abdome total em fase portal (40 segundos após a fase arterial) e novamente do abdome superior na fase de equilíbrio (150 segundos após a fase arterial). O início da detecção na fase arterial foi disparado automaticamente pelo tomógrafo após a contrastação adequada do sistema vascular arterial (SureStart®; Toshiba Medical Systems, Japão). Foi utilizado meio de contraste venoso não iônico (Iopromida - Ultravist 300; Bayer Schering Pharma AG, Berlim, Alemanha), com volume de 1,5 mL/kg injetado em veia ulnar com acesso venoso de 18G ou 20G, e fluxo de 3,5 mL/s, por meio de bomba infusora automatizada (MedRad; Warrendale, EUA). A fase sem meio de contraste venoso foi utilizada para detecção de esteatose hepática e de calcificações patológicas, e como base de comparação para o padrão de realce das lesões gástricas e eventuais lesões linfonodais ou metastáticas detectadas. As fases arterial e tardia foram utilizadas para a avaliação do nível de profundidade da invasão tumoral (estadiamento T) e na caracterização de eventuais lesões hepáticas, conforme o protocolo descrito por Chen et al.(12), e a fase portal foi utilizada para a avaliação linfonodal (estadiamento N) e das demais estruturas abdominais (estadiamento M). Os parâmetros tomográficos técnicos utilizados foram: espessura de corte de 64 × 0,625 mm, reconstrução com espessura de 1 mm, velocidade de rotação de 0,5 s, 120 kVp e mecanismo de modulação automático de corrente (mAs), visando a otimização e redução da dose de radiação efetiva. Após a aquisição das imagens, os estudos foram armazenados no formato DICOM em mídia do tipo DVD, para posterior análise em estação de trabalho radiológica. Definições de estadiamento e análise de imagens Dois radiologistas especializados em doenças abdominais, ambos com sete anos de experiência em radiologia abdominal, foram responsáveis pela análise das imagens. Eles não tiveram acesso aos resultados endoscópicos, tamanho ou localização das lesões. As imagens foram analisadas no programa Osirix, software especializado em processamento de imagens padrão DICOM (Pixmeo; Genebra, Suíça). Os dados de estadiamento tomográfico foram então comparados com o resultado cirúrgico e anatomopatológico obtido. Na época do desenho e implantação deste estudo e da coleta da maior parte dos dados, estava em vigor a sexta edição da classificação TNM. Como em 2010 foi publicada a sétima versão, reclassificamos os dados de acordo com a nova classificação, discriminando as respectivas categorias quando necessário. As definições utilizadas no estadiamento patológico e tomográfico estão descritas na Tabela 1. Os linfonodos foram considerados positivos no estudo tomográfico quando mediram mais que 6 mm no menor eixo e situados em cadeias perigástricas ou quando mediram mais que 8 mm no menor eixo nas demais cadeias. Também foram considerados positivos agrupamentos de três ou mais linfonodos na mesma cadeia, mesmo que de dimensões normais. Foram agrupados nas categorias da classificação TNM conforme a sua sétima edição (N0 - sem doença linfonodal; N1 - 1 ou 2 linfonodos positivos; N2 - 3 a 6 linfonodos positivos; N4 - 7 ou mais linfonodos positivos). Foi considerado apenas o número de linfonodos perigástricos radiologicamente positivos, sem levar em consideração a cadeia afetada ou a distância em relação ao tumor gástrico, segundo as orientações da sétima edição da classificação TNM. Finalmente, os pacientes foram classificados em M0 ou M1, conforme a ausência ou presença de sinais de doença metastática. Foram realizadas análises estatísticas buscando obter os valores de sensibilidade, especificidade e acurácia no estadiamento do adenocarcinoma gástrico, para as categorias T, N e M, bem como a acurácia global para cada uma destas categorias. A observância interobservadores foi avaliada por método estatístico de kappa ponderado, de acordo com Landis (< 0: pobre; 0,01-0,20: discreta; 0,21-0,40: razoável; 0,41-0,60: moderada; 0,61-0,80: substancial; 0,81-1,0: quase perfeita). RESULTADOS Estadiamento do grau de invasão tumoral (categoria T) Os resultados do estadiamento T do câncer gástrico encontram-se sumarizados na Tabela 2. A acurácia na classificação das categorias T variou entre 74% e 96% para o observador 1 e entre 80% e 92% para o observador 2. A acurácia global foi 70% para ambos os observadores. A concordância entre os observadores foi substancial, demonstrada por um valor de kappa ponderado de 0,75. 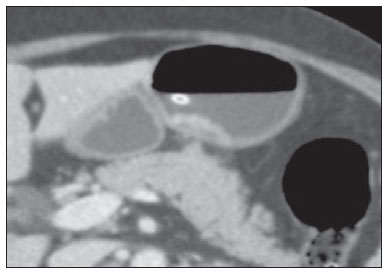 Figura 1. Espessamento focal ou realce anômalo da mucosa gástrica, com preservação de faixa hipodensa profunda à lesão, que corresponde à camada submucosa - categoria T1 na análise histopatológica. 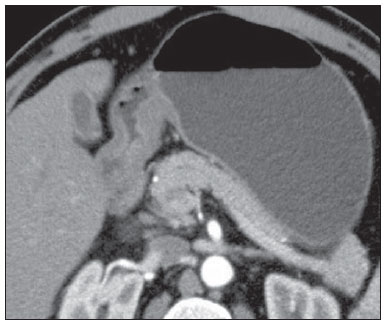 Figura 2. Espessamento e realce anômalo da parede gástrica por toda a sua espessura, com contorno externo do estômago liso - categoria T2 na análise histopatológica. 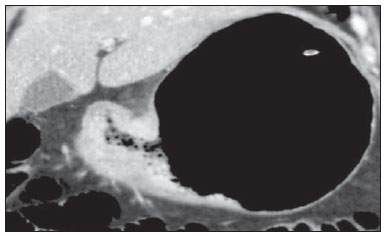 Figura 3. Espessamento e realce anômalo da parede gástrica por toda a sua espessura, associado a estriações lineares ou reticulares que se estendem à gordura perigástrica - categoria T4A após análise histopatológica. 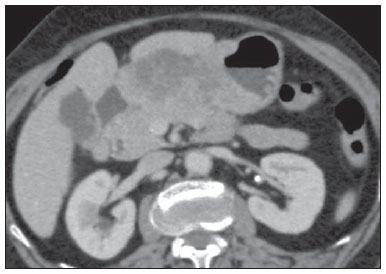 Figura 4. Sinais de invasão da cabeça e corpo do pâncreas - categoria T4B. Os dados foram a seguir organizados para se responder três perguntas de importância clínica fundamental no estadiamento pré-operatório: 1. O tumor em questão é um câncer gástrico precoce (T1 vs. T2-4)? Estadiamento do grau de acometimento linfonodal (categoria N) Os resultados do estadiamento N do câncer gástrico encontram-se sumarizados na Tabela 3. 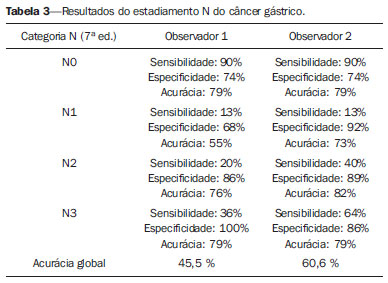 A acurácia na classificação das categorias N variou entre 55% e 79% para o observador 1 e entre 73% e 82% para o observador 2. A acurácia global foi 45,5% para o observador 1 e 60,6% para o observador 2. Estadiamento do acometimento metastático (categoria M) Os resultados do estadiamento M do câncer gástrico encontram-se sumarizados na Tabela 4. A acurácia global foi 89,6% para ambos os observadores. 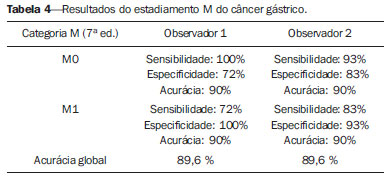 Três casos foram categorizados como M0 na avaliação pré-operatória, mas durante o procedimento cirúrgico foram encontrados implantes peritoneais metastáticos, posteriormente confirmados por análise histopatológica. Após análise retrospectiva, um destes casos apresentava pequena quantidade de ascite no fundo de saco posterior, mas em nenhum dos casos foi possível detectar implantes peritoneais pelo estudo tomográfico. DISCUSSÃO Neste estudo, os dados mostraram alta acurácia da tomografia na classificação da categoria T, particularmente na sua capacidade de responder às perguntas de maior relevância clínica, a saber: 1) se o tumor em questão é um câncer gástrico precoce (acurácia de 88-92%); 2) se, em caso de tumor localmente avançado, há sinais de extensão extrasserosa (acurácia de 82-86%), e caso positivo; 3) se há sinais de invasão de órgãos adjacentes (acurácia de 86-96%). A acurácia do estadiamento tomográfico é menor na diferenciação entre as categorias T2 e T3 (ambas restritas à parede gástrica), mas esta diferenciação não é crucial no pré-operatório, haja vista que são manejadas clinicamente da mesma forma. A acurácia previamente relatada na literatura para o estadiamento do grau de invasão tumoral (categoria T) varia entre 66% e 88%(10,16,18-22). Neste estudo, encontramos uma acurácia global de 70% para ambos os observadores, em concordância com os dados previamente disponíveis. Alguns fatores contribuíram para reduzir a acurácia no presente estudo. Nossa casuística tem grande proporção de neoplasias avançadas, em concordância com os dados populacionais habitualmente encontrados em casuísticas de países ocidentais, particularmente em países em desenvolvimento. Nas casuísticas de países orientais, são mais frequentes casos de câncer gástrico precoce. Enquanto tivemos 20% de casos T1, Yang et al.(22), por exemplo, trabalharam com uma amostra em que 40% dos pacientes tiveram estadiamento histopatológico T1. Como a acurácia no estadiamento T é mais alta na categoria T, este dado clínico reduz a acurácia global do estadiamento. Apesar de ainda não haver clara comprovação na literatura, provavelmente a nova edição (sétima) da classificação TNM acarreta em menores índices de acurácia no estadiamento tomográfico, já que todos os casos restritos à parede gástrica são divididos em três categorias (T1, T2 ou T3) e apenas os casos com extensão extrasserosa são classificados como T4, tornando mais difícil ao radiologista esta subestratificação. A maior parte dos trabalhos disponíveis utilizou a sexta edição do TNM, situando como T3 os tumores com extensão extrasserosa. Estão atualmente em curso estudos para validação clínica da sétima edição do TNM, e as evidências atualmente disponíveis apontam que a sétima edição é melhor que a sexta na categoria T, mas pior na categoria N(23,24). Novos estudos de validação clínica e do estadiamento pré-operatório baseados na sétima edição ainda são necessários. Outra dificuldade já relatada na literatura é quando há tênues opacidades reticulares na gordura perigástrica adjacente ao tumor, que mais comumente representam extensão tumoral extrasserosa (categoria T4A), mas que ocasionalmente decorrem de processo inflamatório, causando falsopositivos quando interpretadas como extensão tumoral(25,26). No presente estudo, tivemos três casos de T3 interpretados como T4A (falso-positivos), por ambos os observadores. Já na avaliação do estadiamento do acometimento linfonodal, também em concordância com a literatura disponível(14,27,28), os resultados não foram tão bons, com acurácias globais de 45,5% para o observador 1 e 60,6% para o observador 2. Contudo, a tomografia teve melhor resultado na categoria N0, com sensibilidade de 90%, especificidade de 74% e acurácia de 79%. Assim, o método tomográfico conseguiu demonstrar a ausência de acometimento linfonodal secundário com bom grau de acurácia. Não há consenso definido na literatura a respeito do tamanho do linfonodo que seja considerado positivo no estudo tomográfico. Os critérios adotados no atual estudo (> 6 mm no menor eixo para linfonodos perigástricos e > 8 mm para as demais cadeias) resultam em maior sensibilidade, mas à custa de redução na especificidade dos achados(27). Apesar de haver clara correlação entre as dimensões do linfonodo e o envolvimento neoplásico, a tomografia computadorizada tem uma limitação inerente, já que linfonodos podem aumentar de dimensões de modo reacional, inflamatório, e linfonodos de dimensões normais podem abrigar implantes metastáticos. O advento recente da fusão da tecnologia da tomografia computadorizada com o tomógrafo com emissão de pósitrons pode melhorar a especificidade do estadiamento linfonodal, mas novas pesquisas ainda são necessárias nesse sentido. A tomografia computadorizada também mostrou excelente resultado na definição de doença metastática, com acurácia de 89,6%. O acometimento metastático pode ocorrer por via hematogênica, linfática ou peritoneal. A maior limitação atual da tomografia computadorizada é na detecção do acometimento peritoneal secundário(29). No presente estudo, três casos foram categorizados como M0 no estadiamento pré-operatório, mas apresentavam pequenos implantes peritoneais secundários, confirmados após análise histopatológica. A reavaliação retrospectiva da tomografia destes três pacientes revelou que um destes casos apresentava como único achado apenas pequena quantidade de ascite no fundo de saco posterior pélvico, e em nenhum destes casos foi possível detectar implantes peritoneais, mesmo retrospectivamente, evidenciando a limitação do método para implantes milimétricos. Em casos selecionados, a complementação com estudos de PET/TC e ressonância magnética, particularmente com sequência ponderada em difusão, pode aumentar a sensibilidade e a especificidade na pesquisa de implantes peritoneais. Outra estratégia frequentemente empregada é a utilização de videolaparoscopia diagnóstica no início da abordagem cirúrgica, visando a detecção de acometimento peritoneal secundário. O achado de ascite na tomografia computadorizada deve ser valorizado no contexto de neoplasia gástrica avançada. Segundo Yajima et al.(30), o achado de ascite prediz carcinomatose peritoneal com sensibilidade de 51% e especificidade de 97%. Uma desvantagem da tomografia computadorizada é a exposição do paciente à radiação ionizante. O protocolo adotado na literatura para estadiamento pré-operatório do câncer gástrico, com múltiplas aquisições antes e após a administração de meio de contraste, implica em uma exposição relativamente alta. É importante considerar que a população acometida pelo câncer gástrico tem idade relativamente avançada (média de 66 anos neste estudo) e neoplasia de alta mortalidade, e não há estudos que comprovem acurácia equivalente com protocolos mais resumidos, sendo esta uma oportunidade para futuras pesquisas. Uma estratégia frequentemente empregada é reduzir o número de fases tomográficas no acompanhamento oncológico pós-operatório destes pacientes. CONCLUSÃO A tomografia computadorizada com múltiplos canais de detectores é atualmente indispensável na avaliação pré-operatória de pacientes com câncer gástrico e sua realização já consta nas recomendações dos consensos internacionais mais recentes. O método tomográfico apresenta excelente acurácia no estadiamento da profundidade de invasão (categoria T) e no estadiamento de doença neoplásica metastática (categoria M). O maior limitante, atualmente, é o adequado estadiamento do acometimento linfonodal, apesar de uma boa acurácia em pacientes sem doença linfonodal (N0). REFERÊNCIAS 1. Ferlay J, Soerjomataram I, Ervik M, et al. Globocan 2012 v1.0, Cancer incidence and mortality worldwide: IARC CancerBase No. 11 [Internet]. Lyon, France: International Agency for Research on Cancer; 2013. [cited 2013 Dec 12]. Available from: http://globocan.iarc.fr. 2. Thrumurthy SG, Chaudry MA, Hochhauser D, et al. The diagnosis and management of gastric cancer. BMJ. 2013;347:f6367. 3. Blakely AM, Miner TJ. Surgical considerations in the treatment of gastric cancer. Gastroenterol Clin North Am. 2013;42:337-57. 4. Edge S, Byrd DR, Compton CC, et al. AJCC cancer staging handbook. 7th ed. New York: Springer-Verlag; 2010. 5. Lee MH, Choi D, Park MJ, et al. Gastric cancer: imaging and staging with MDCT based on the 7th AJCC guidelines. Abdom Imaging. 2012;37:531-40. 6. Park SR, Kim MJ, Ryu KW, et al. Prognostic value of preoperative clinical staging assessed by computed tomography in resectable gastric cancer patients: a viewpoint in the era of preoperative treatment. Ann Surg. 2010;251:428-35. 7. Furukawa K, Miyahara R, Itoh A, et al. Diagnosis of the invasion depth of gastric cancer using MDCT with virtual gastroscopy: comparison with staging with endoscopic ultrasound. AJR Am J Roentgenol. 2011;197:867-75. 8. Coburn N, Seevaratnam R, Paszat L, et al. Optimal management of gastric cancer: results from an international RAND/UCLA expert panel. Ann Surg. 2014;259:102-8. 9. Dixon M, Cardoso R, Tinmouth J, et al. What studies are appropriate and necessary for staging gastric adenocarcinoma? Results of an international RAND/UCLA expert panel. Gastric Cancer. 2014;17:377-82. 10. Kim AY, Kim HJ, Ha HK. Gastric cancer by multidetector row CT: preoperative staging. Abdom Imaging. 2005;30:465-72. 11. Kim YH, Lee KH, Park SH, et al. Staging of T3 and T4 gastric carcinoma with multidetector CT: added value of multiplanar reformations for prediction of adjacent organ invasion. Radiology. 2009;250:767-75. 12. Chen CY, Hsu JS, Wu DC, et al. Gastric cancer: preoperative local staging with 3D multi-detector row CT - correlation with surgical and histopathologic results. Radiology. 2007;242:472-82. 13. Moschetta M, Stabile Ianora AA, Anglani A, et al. Preoperative T staging of gastric carcinoma obtained by MDCT vessel probe reconstructions and correlations with histological findings. Eur Radiol. 2009;20:138-45. 14. Kwee RM, Kwee TC. Imaging in assessing lymph node status in gastric cancer. Gastric Cancer. 2009;12:6-22. 15. Kwee RM, Kwee TC. Imaging in local staging of gastric cancer: a systematic review. J Clin Oncol. 2007;25:2107-16. 16. Sohn KM, Lee JM, Lee SY, et al. Comparing MR imaging and CT in the staging of gastric carcinoma. AJR Am J Roentgenol. 2000;174:1551-7. 17. Motohara T, Semelka RC. MRI in staging of gastric cancer. Abdom Imaging. 2002;27:376-83. 18. Habermann CR, Weiss F, Riecken R, et al. Preoperative staging of gastric adenocarcinoma: comparison of helical CT and endoscopic US. Radiology. 2004;230:465-71. 19. Kumano S, Okada M, Shimono T, et al. T-staging of gastric cancer of air-filling multidetector-row CT: comparison with hydromultidetector-row CT. Eur J Radiol. 2012;81:2953-60. 20. Bhandari S, Shim CS, Kim JH, et al. Usefulness of three-dimensional, multidetector row CT (virtual gastroscopy and multiplanar reconstruction) in the evaluation of gastric cancer: a comparison with conventional endoscopy, EUS, and histopathology. Gastrointest Endosc. 2004;59:619-26. 21. Shimizu K, Ito K, Matsunaga N, et al. Diagnosis of gastric cancer with MDCT using the water-filling method and multiplanar reconstruction: CT-histologic correlation. AJR Am J Roentgenol. 2005;185:1152-8. 22. Yang DM, Kim HC, Jin W, et al. 64 multidetector-row computed tomography for preoperative evaluation of gastric cancer: histological correlation. J Comput Assist Tomogr. 2007;31:98-103. 23. Graziosi L, Marino E, Cavazzoni E, et al. Prognostic value of the seventh AJCC/UICC TNM classification of non-cardia gastric cancer. World J Surg Oncol. 2013;11:103. 24. Hayashi T, Yoshikawa T, Bonam K, et al. The superiority of the seventh edition of the TNM classification depends on the overall survival of the patient cohort: comparative analysis of the sixth and seventh TNM editions in patients with gastric cancer from Japan and the United Kingdom. Cancer. 2013;119:1330-7. 25. Chen CY, Wu DC, Kang WY, et al. Staging of gastric cancer with 16-channel MDCT. Abdom Imaging. 2006;31:514-20. 26. Makino T, Fujiwara Y, Takiguchi S, et al. Preoperative T staging of gastric cancer by multi-detector row computed tomography. Surgery. 2011;149:672-9. 27. Mönig SP, Zirbes TK, Schröder W, et al. Staging of gastric cancer: correlation of lymph node size and metastatic infiltration. AJR Am J Roentgenol. 1999;173:365-7. 28. Morgagni P, Petrella E, Basile B, et al. Preoperative multidetectorrow computed tomography scan staging for lymphatic gastric cancer spread. World J Surg Oncol. 2012;10:1-5. 29. Kim SJ, Kim HH, Kim YH, et al. Peritoneal metastasis: detection with 16- or 64-detector row CT in patients undergoing surgery for gastric cancer. Radiology. 2009;253:407-15. 30. Yajima K, Kanda T, Ohashi M, et al. Clinical and diagnostic significance of preoperative computed tomography findings of ascites in patients with advanced gastric cancer. Am J Surg. 2006;192:185-90. 1. Médicos Radiologistas do Hospital de Clínicas da Universidade Estadual de Campinas (Unicamp), Campinas, SP, Brasil 2. Doutor, Professor Titular do Departamento de Cirurgia da Universidade Estadual de Campinas (Unicamp), Campinas, SP, Brasil 3. Doutor, Professor do Departamento de Radiologia da Universidade Estadual de Campinas (Unicamp), Campinas, SP, Brasil Endereço para correspondência: Dr. Ricardo Hoelz de Oliveira Barros Universidade Estadual de Campinas - Departamento de Radiologia Rua Tessália Vieira de Camargo, 126, Cidade Universitária Zeferino Vaz Campinas, SP, Brasil, 13083-970 E-mail: rhobarros@hotmail.com Recebido para publicação em 17/3/2014. Aceito, após revisão, em 2/10/2014. Trabalho realizado no Departamento de Radiologia da Universidade Estadual de Campinas (Unicamp), Campinas, SP, Brasil. |
|
Av. Paulista, 37 - 7° andar - Conj. 71 - CEP 01311-902 - São Paulo - SP - Brazil - Phone: (11) 3372-4544 - Fax: (11) 3372-4554