Radiologia Brasileira - Publicação Científica Oficial do Colégio Brasileiro de Radiologia
AMB - Associação Médica Brasileira CNA - Comissão Nacional de Acreditação
 Vol. 48 nº 2 - Mar. / Abr. of 2015
Vol. 48 nº 2 - Mar. / Abr. of 2015
|
ARTIGO ORIGINAL
|
|
|
|
|
Autho(rs): Jeam Haroldo Oliveira Barbosa1; Antonio Carlos Santos2; Carlos Ernesto Garrido Salmon3 |
|
|
Descritores: SWI; Ressonância magnética; Suscetibilidade magnética; Calcificação; Hemossiderina. |
|
|
Resumo: INTRODUÇÃO
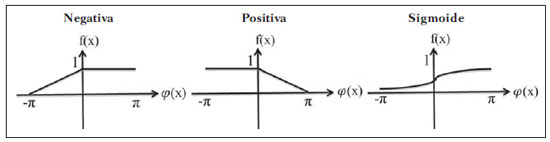
As imagens por ressonância magnética (RM) mais utilizadas na prática clínica são fundamentalmente ponderadas nos tempos de relaxação nuclear dos tecidos. Nestas imagens o contraste é baseado nas diferenças significativas de tempo de relaxação transversal (T2) e/ou longitudinal (T1) na região em estudo. No entanto, as imagens ponderadas em relaxometria não diferem hemossiderina e calcificação, porque ambas diminuem os tempos de relaxação em razão da inomogeneidade de campo magnético gerado pelos átomos paramagnéticos e diamagnéticos, respectivamente. Por outro lado, a imagem ponderada em suscetibilidade magnética (susceptibility weighted imaging - SWI) contrasta calcificações e depósitos de hemossiderinas(1,2). Desta forma, a imagem SWI tem complementado o diagnóstico clínico de distúrbios neurológicos (traumatismo cranioencefálico e coágulos danosos), de distúrbios hemorrágicos (má-formação vascular, infarto cerebral e neoplasias) e de ocorrências neuroinfecciosas (neurotoxoplasmose e neurocisticercose)(3). A imagem SWI é gerada por meio da multiplicação da imagem de magnitude por uma máscara, com valores entre 0 e 1, obtida a partir da imagem de fase. Ambas as imagens são geralmente adquiridas usando uma sequência clínica convencional de eco de gradientes (gradient echo - GE) com um apropriado tempo de eco (TE)(4). A principal informação sobre a distribuição de suscetibilidade (χ) na imagem SWI está na imagem de fase, onde a fase (φ) em uma determinada posição (r) e com certo TE é de, aproximadamente: 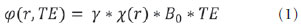 sendo γ a razão giro magnética do núcleo de hidrogênio. Se considerarmos como fase de referência a fase dos núcleos nas moléculas de água contidas na maior parte do tecido cerebral sadio, a equação 1 pode ser expressa em termos de diferença de fase: 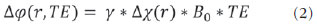 onde Δχ(r) é a diferença de χtecido - χágua. Assim, para TEs relativamente curtos esta variação de fase assume valores entre 0 e +Π para tecido paramagnético (Δχ > 0) e -Π a 0 para tecido diamagnético (Δχ < 0). A mudança de sinal em ambos os casos pode ser explicada pelas propriedades magnéticas dos átomos de ferro e de cálcio. Destacando que as definições feitas acima consideram o sistema de referência "mão esquerda", o qual define que a intensidade 0 na imagem de fase é Π e a intensidade 4095 é -Π, já o sistema "mão direita" define este intervalo ao contrário (-Π a Π). Cada fabricante adota um sistema de referência. Para descobrir o sistema de referência é necessário apenas observar os valores de fase dos vasos sanguíneos e dos gânglios da base, os quais são paramagnéticos. Embora a SWI seja uma técnica já constituída, a tomografia computadorizada (TC) continua sendo considerada como a técnica conclusiva no diagnóstico diferencial de calcificação cerebral(2). Além dos conhecidos fatores econômicos envolvendo TC e RM, consideramos que a utilização mais extensiva da SWI como técnica conclusiva no mencionado diagnóstico é afetada por duas escolhas de extrema importância no correto uso desta técnica: o valor do TE na aquisição das imagens e o tipo de máscara na etapa de pós-processamento. Estas duas escolhas influenciam o contraste em suscetibilidade magnética na imagem SWI. O efeito destes parâmetros torna-se de difícil interpretação, pela limitação da fase assumir valores somente dentro do intervalo de -Π a +Π. Quando o valor da fase do tecido ultrapassa a escala de Π, para TEs longos, a fase da imagem assume valor somado de -2Π. Este efeito é denominado, em inglês, de wrapping(5). A seleção incorreta do TE pode definir erroneamente o contraste em suscetibilidade magnética na imagem SWI. Neste trabalho é exposto em detalhes o processamento da imagem SWI, destacando o efeito da escolha do TE e da máscara sensível à diferenciação de calcificação e hemossiderina, simultaneamente, em seis pacientes com diferentes hipóteses diagnósticas. Adicionalmente, verificamos a efetividade deste procedimento, considerando como padrão ouro a imagem de TC. MATERIAIS E MÉTODOS Sujeitos Para ilustrar a aplicação da técnica de SWI e sua validade, foram selecionados seis pacientes (idades entre 41 e 54 anos; quatro homens). A seleção foi feita de forma retrospectiva à aquisição das imagens e seguindo os critérios: a) suspeita diagnóstica de neurotoxoplasmose, cistos ventriculares e depósitos de hemossiderina; b) estudos de neuroimagem de TC e de RM com um intervalo menor de três meses (exceto para um paciente de suspeita de neurotoxoplasmose com intervalo interexame de 10 meses); c) ausência de artefatos em ambas as modalidades de imagens; d) laudos emitidos e revisados por ao menos dois neurorradiologistas com confirmação da suspeita diagnóstica. Parâmetros de imagem Imagens por RM de fase e de magnitude foram adquiridas em plano axial por uma sequência GE 3D (PRESTO), em equipamento de campo magnético de 3,0 T (Achieva; Philips), com bobina de cabeça de oito canais com capacidade para aplicar a técnica SENSE. Os parâmetros da sequência utilizada foram: TE de 23,1 ms, tempo de repetição de 16,3 ms, ângulo de flip de 10°, resolução espacial de 0,57 × 0,57 × 0,85 mm3, campo de visão (field of view - FOV) de 218 × 218 × 127 mm3 e SENSE = 2. As imagens de TC foram adquiridas em equipamento Brilliance Big Bore (Philips) em plano axial com os seguintes parâmetros: 257 mAs/120 kV, resolução espacial de 0,39 × 0,39 × 5,0 mm3, com FOV de 199 × 199 × 150 mm3. Processamento da imagem SWI De modo geral, as imagens SWI são formadas por meio da multiplicação da máscara de fase pela imagem de magnitude (Figura 1). A geração da máscara de fase consiste de duas etapas: aplicação de um filtro de remoção de baixas frequências e criação de máscara com valores entre 0 e 1 de acordo com o intervalo de fase desejado. Seguem em detalhes estas duas etapas. 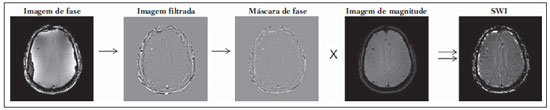 Figura 1. Diagrama do processamento da imagem SWI com máscara sigmoide. Paciente com depósito de calcificação. O filtro de remoção de baixas frequências é aplicado na imagem de fase para remover ou atenuar as componentes de baixas frequências espaciais formadas pela não homogeneidade do campo magnético de fundo (Figura 1)(6). Essas componentes são responsáveis pelas variações espaciais mais suaves na imagem, e assim não representam variáveis locais e sim globais, tais como o contraste total e a intensidade média do pixel. O campo magnético de fundo é considerado como aquele gerado por fontes localizadas fora do objeto, como, por exemplo, inomogeneidade de campo magnético estático (B0) e não-uniformidade do campo de radiofrequência. Diferentes tipos de filtro de remoção de baixas frequência podem ser usados, e neste trabalho foi utilizada uma versão simples de filtro, como sugerido por Haacke et al.(7). Neste filtro a imagem de fase original é subtraída da imagem de fase com apenas baixas frequências, resultando em uma imagem de fase com remoção de baixas frequências, sendo a subtração realizada com as imagens no domínio real. A remoção de altas frequências da imagem citada é dada por meio de um truncamento central n × n pontos no espaço k(2D) da imagem de fase e adicionando zeros aos pontos fora da região truncada. O tamanho da janela (n × n) dependerá da razão sinal/ruído na imagem de fase e da eliminação do campo de fundo. Um valor conveniente é 64 × 64, considerando a imagem do cérebro com um FOV próximo de 256 mm. A outra etapa, a geração da máscara de fase, é o ponto mais importante do processamento da imagem SWI. A ponderação em contraste paramagnético ou diamagnético é definida nesta etapa. A imagem de fase pode assumir apenas valores de -Π a +Π pelas propriedades da transformada de Fourier e limitação do sistema de aquisição do sinal de RM. Desta forma, podem aparecer descontinuidades de valores de até 2Π na imagem de fase, caso o valor ultrapasse um destes limites. Este efeito é mais frequente para TEs longos, como mostrado na Figura 2. Nesta figura são apresentadas imagens de fase com TE = 23 ms (Figura 2A) e TE = 40 ms (Figura 2B), esta última obtida por meio de simulação da evolução da fase a partir da primeira. De acordo com a equação 2 para valores de diferença de suscetibilidade entre hemossiderina e substância branca (Δχ = 0,25 ppm)(8), observamos, no gráfico da Figura 2, que a diferença de fase em TE = 23 ms é de aproximadamente -Π/2, e para TE = 40 ms este valor deve ser +Π. O wrapping também acontece para a diferença de suscetibilidade entre calcificação e substância branca (Δχ = -0,15 ppm)(8), mostrado no gráfico: em TE = 23 ms a fase é Π/2 e em TE = 40 ms a fase é -2Π/3. Logo, a fase evolui dependentemente com TE e de acordo com a diferença de suscetibilidade dos tecidos. 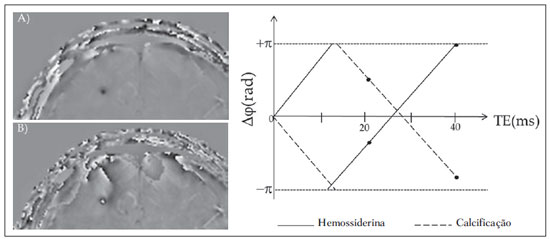 Figura 2. Efeito wrapping da imagem de fase para paciente com depósito de hemossiderina. A e B são imagens de fase de TE = 23 ms e 40 ms, respectivamente. O gráfico contém valores simulados de fase no sistema de referência mão esquerda para regiões com depósito de hemossiderina e calcificação considerando um campo de 3 T. Os pontos em destaque no gráfico indicam os valores de fase para TE = 23 ms e TE = 40 ms. O wrapping sugere valores indesejáveis de TE para a diferenciação das lesões de depósito de hemossiderina e calcificação e dependentes da intensidade do campo magnético da máquina. No caso de 3 T, exemplificado na Figura 2, em TEs próximos de 13 e 27 ms a diferença de fase na região central de ambos os tipos de lesões tende a um mesmo valor, dificultando, assim, uma correta distinção. Adicionalmente, dependendo em que intervalo esteja o TE escolhido, teremos intensidades alternadas entre ambos os tipos de lesões. A máscara de fase baseia-se na relação linear entre a evolução da fase e a suscetibilidade magnética (equação 1), válida para todos os pontos da imagem adquirida em um determinado campo magnético (B0) e com um único TE. Esta máscara é aplicada para realçar as diferenças nas imagens de fase tomando como base as imagens de magnitude com um aspecto mais anatômico e de mais fácil interpretação. Diferentes máscaras podem ser definidas, com valores sempre entre 0 e 1 (Figura 3). Um exemplo comum e de fácil ilustração é a máscara negativa, em que se assume um valor unitário para fase maiores que 0 e de 0 até 1 para valores de fase de -Π a 0. Outro exemplo é a máscara positiva, que assume 1 para valores de fase menores que 0 e 0 até 1 para valores de fase de 0 a Π. As máscaras anteriores podem ser usadas individualmente para realçar um tipo específico de lesão. Já a máscara sigmoide(9) é mais geral e permite diferenciar tecido paramagnético de tecido diamagnético em uma única imagem SWI. Esta máscara segue os valores da função sigmoide descrita na equação 3: 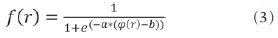 Os parâmetros de ajuste "a" e "b" são livremente selecionados para alcançar uma boa relação de contraste/ruído(9). Como nosso objetivo é diferenciar tecido paramagnético e diamagnético, nós utilizamos neste trabalho a máscara sigmoide para processar as imagens SWI e os parâmetros selecionados foram a = 0,5 e b = -0,15. Posteriormente, a máscara de fase é multiplicada n vezes sobre a imagem de magnitude para gerar a imagem SWI. O número n de multiplicações deve ser escolhido para otimizar a razão contraste/ruído em SWI, e segundo demonstrado por Reichenbach et al. este número deve ser igual a 4(10). Na Figura 4 é exemplificada a mudança do contraste/ruído para o uso de máscara sigmoide multiplicada 4, 6 e 8 vezes sobre a imagem de magnitude de um paciente com depósito de hemossiderina. 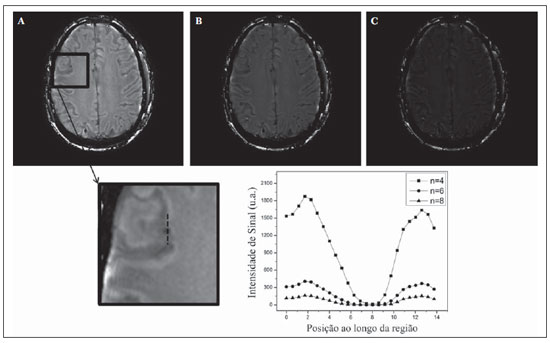 Figura 4. Imagens SWI de um paciente com depósito de hemossiderina (indicado com linha tracejada) com diferentes multiplicações da máscara sigmoide: A: n = 4; B: n = 6; C: n = 8. O gráfico contem os valores de intensidade de sinal para as imagens SWI ao longo do perfil indicado pela reta pontilhada na figura com ampliação. Neste trabalho, o processamento da imagem SWI foi realizado em rotina própria no programa Matlab. Em resumo, foi selecionado filtro de remoção de baixas frequências com tamanho de janela de 64 × 64(11), máscara sigmoide multiplicada 4 vezes(10). Efeito da distribuição espacial da fase em regiões vizinhas à lesão Além da diferença de fase possuir uma dependência pontual com a diferença de suscetibilidade do tecido como foi aproximado pela equação 1, a Δφ(r,TE) também é afetada nas vizinhanças, fato muito observado nos cortes inferiores e superiores à deposição de hemossiderina ou calcificação (Figura 5). Uma forma mais geral de escrever a equação 2 é expressar Δφ(r,TE) como uma função linearmente dependente da perturbação no campo magnético principal ΔB(r) ao longo da direção de B0; as outras componentes são desconsideradas: 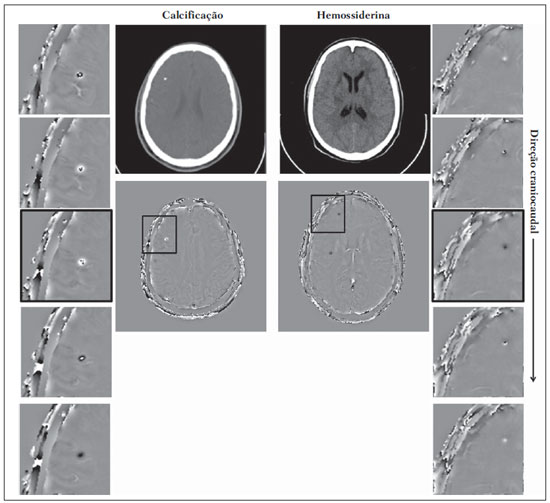 Figura 5. Imagens de fase filtrada (64 × 64) de um paciente portador de calcificação e outro com depósito de hemossiderina comprovado por imagem de TC. Estas imagens demonstram o efeito não local da evolução de fase nos cortes inferiores e superiores à deposição e com comportamento contrário para calcificação e hemossiderina. 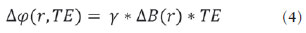 Se considerarmos os depósitos de calcificação e de hemossiderina com geometria esférica e centrada na origem, a perturbação do campo magnético em um ponto arbitrário decorrente destes depósitos pode ser escrita como(12): 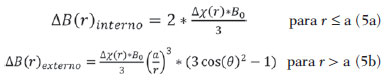 onde a é o raio da lesão esférica e θ é o ângulo formado entre o vetor posição (r) e o eixo do campo magnético principal (eixo z). Com as equações 4, 5a e 5b simulamos o efeito da evolução de fase nos cortes inferiores e superiores a uma deposição de calcificação e hemossiderina com raio de 10 mm, considerando um campo de 3 T e um TE = 23 ms. Nesta simulação também assumimos Δχ = 0,25 ppm para hemossiderina e Δχ = -0,20 ppm para calcificação. RESULTADOS De todos os seis pacientes estudados, apenas quatro (denominados 1, 2, 3 e 4) apresentaram calcificações nas imagens de TC. Para estes pacientes, as imagens SWI apresentaram sinal hiperintenso para as regiões de calcificações (Figura 6, setas contínuas). Os outros dois pacientes (denominados 5 e 6) não apresentaram calcificações nas imagens de TC e apresentaram depósito de hemossiderina com hipointensidade na imagem SWI (Figura 6, setas pontilhadas). 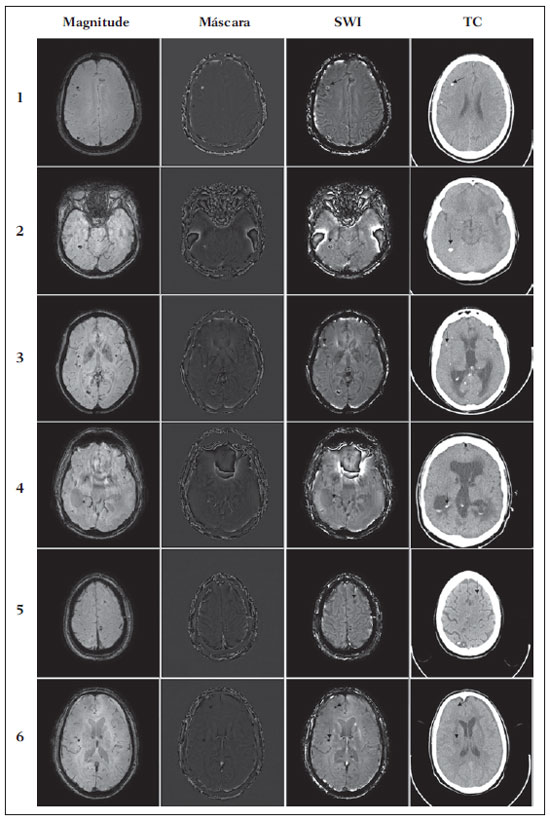 Figura 6. Imagens de magnitude, máscara (multiplicada 4 vezes), SWI e TC, em cada uma das colunas, representativas dos sujeitos envolvidos neste estudo. Nas imagens de SWI, processadas com máscara sigmoide, e na respectiva imagem de TC são indicadas as regiões de calcificação (seta contínua) ou de hemossiderina (seta pontilhada), segundo o caso. O filtro de remoção de baixas frequências de 64 × 64 pixels utilizado não foi capaz de filtrar alguns artefatos de wrapping que apareceram na imagem SWI dos sujeitos 2 e 4. Estes artefatos ocorrem geralmente para regiões de alta diferença de suscetibilidade magnética, como a região dos seios nasais e ouvidos. A Figura 7 mostra o efeito de evolução de fase nos cortes inferiores e superiores ao raio da calcificação e deposição de hemossiderina simulada. Regiões fora da lesão mostram valores de fase induzidos pela lesão vizinha.  Figura 7. Imagem de calcificação e depósito de hemossiderina em geometria esférica para simular o efeito de evolução de fase nos cortes inferiores e superiores à esfera de raio 10 mm. Foi considerado um campo de 3 T e um TE = 23 ms. DISCUSSÃO A imagem SWI tem sido sugerida para identificar depósito de hemossiderina e calcificação cerebral(2). A análise que propomos permitiu a diferenciação destes depósitos por meio de imagem SWI com máscara sigmoide e os resultados foram validados por imagem de TC. Depósitos de hemossiderina contêm átomos de Fe+3, os quais são paramagnéticos e distorcem o campo magnético local ao nível molecular(12). A distorção do campo magnético faz com que cada spin nuclear do tecido interaja diferentemente com o campo magnético local. Portanto, a fase resultante do voxel com depósito de hemossiderina evolui muito mais do que o tecido normal no voxel vizinho. Calcificações contêm átomos diamagnéticos de Ca+2 que também distorcem o campo e promovem evolução de fase dos spins. A evolução de fase devida à calcificação é em sentido contrário de depósitos de Fe+3. Portanto, para determinado TE é possível diferenciar depósito de hemossiderina e calcificação (Figura 2). Para o TE de 23 ms em 3 T as calcificações dos pacientes apareceram com sinal hiperintenso na imagem SWI com máscara sigmoide e em concordância com os relatos de calcificações em oligodendrogliomas, lesões fisiológicas e de cisticercose(13), e em câncer de próstata(14). Imagens SWI com TEs mais longos podem gerar resultados opostos aos citados acima. Recentemente, Zulfiqar et al. utilizaram um TE de 40 ms e reportaram sinal hipointenso para calcificações em oligodendrogliomas na imagem SWI com máscara negativa(15). Além disso, concluíram que entre as técnicas de diagnóstico de calcificações cerebrais por RM, a imagem SWI foi a mais indicada para detectar calcificações em oligodendrogliomas, com resultados confirmados por imagem de TC(15). Outros autores utilizaram TE de 25 ms e também reportaram sinal hipointenso para calcificações em imagem SWI com máscara negativa(16), contudo, o campo magnético estático era menos intenso (1,5 T). Como mostrado na equação 2, a fase evolui menos para campos magnéticos menores. Além disso, devemos destacar que a imagem de fase pode assumir valores contrários quando se utiliza o sistema de referência mão direita. Dessa forma, devemos salientar que os resultados apresentados na literatura na temática aqui discutida devem ser olhados com certo cuidado para sua aplicação na realidade clínica de cada centro. Adicionalmente, a maioria dos fabricantes de equipamentos de imagens de RM já inclui no produto a sequência de aquisição SWI com um pós-processamento automático, e a cada dia o uso desta imagem na clínica é mais comum. No entanto, ressaltamos que a imagem SWI é pós-processada e depende da escolha do tipo de máscara e de alguns parâmetros que muitas vezes ficam ocultos para os radiologistas. Diagnósticos clínicos podem ser erroneamente gerados por responsáveis que não tenham ciência do tipo de parâmetro de pós-processamento que possa variar e/ou que não esteja selecionado corretamente. Neste trabalho, sugerimos que o serviço de diagnóstico padronize o uso de imagem SWI por meio da escolha correta do TE para a construção da máscara de fase que seja capaz de contrastar hemossiderina ou calcificação, e ambas juntas para evitar possíveis erros no diagnóstico clínico. Como exemplo: aquisição de sequência GE com imagem de fase e magnitude, no sistema de referência mão esquerda, com TE = 23 ms para campo magnético de 3 T e processamento da imagem SWI com filtro de remoção de baixas frequências 64 × 64, com número de multiplicações igual a 4 e máscara sigmoide para marcar hipointenso e hiperintenso regiões paramagnéticas e diamagnéticas, respectivamente. A presença de artefatos de suscetibilidade magnética na região dos seios nasais e dos ouvidos dos pacientes (Figura 6, casos 2 e 4) não prejudicou o diagnóstico e a diferenciação de depósitos de hemossiderina e calcificação. No entanto, em alguns casos este artefato impede a visualização de todo o cérebro. O uso de TE mais curto, filtro com tamanho de janela maior e novos filtros podem remover estes artefatos. CONCLUSÃO SWI é uma imagem gerada por pós-processamento que pondera contraste de suscetibilidade magnética da imagem de fase na imagem de magnitude. A escolha do TE e da máscara pode alterar toda a informação da imagem SWI e comprometer a confiabilidade diagnóstica. Entre as possíveis máscaras, destacamos que a máscara sigmoide permite contrastar calcificação e hemossiderina em uma única imagem SWI. REFERÊNCIAS 1. Gupta D, Saini J, Kesavadas C, et al. Utility of susceptibilityweighted MRI in differentiating Parkinson's disease and atypical parkinsonism. Neuroradiology. 2010;52:1087-94. 2. Berberat J, Grobholz R, Boxheimer L, et al. Differentiation between calcification and hemorrhage in brain tumors using susceptibilityweighted imaging: a pilot study. AJR Am J Roentgenol. 2014;202:847-50. 3. Mittal S, Wu Z, Neelavalli J, et al. Susceptibility-weighted imaging: technical aspects and clinical applications, part 2. AJNR Am J Neuroradiol. 2009;30:232-52. 4. Haacke EM, Xu Y, Cheng YC, et al. Susceptibility weighted imaging (SWI). Magn Reson Med. 2004;52:612-8. 5. Haacke EM, Reichenbach JR. Susceptibility weighted imaging in MRI: basic concepts and clinical applications. Hoboken, NJ: Wiley- Blackwell; 2011. 6. Wang Y, Yu Y, Li D, et al. Artery and vein separation using susceptibility- dependent phase in contrast-enhanced MRA. J Magn Reson Imaging. 2000;12:661-70. 7. Haacke EM, Mittal S, Wu Z, et al. Susceptibility-weighted imaging: technical aspects and clinical applications, part 1. AJNR Am J Neuroradiol. 2009;30:19-30. 8. Schweser F, Deistung A, Lehr BW, et al. Differentiation between diamagnetic and paramagnetic cerebral lesions based on magnetic susceptibility mapping. Med Phys. 2010;37:5165-78. 9. Martínez Santiesteban FM, Swanson SD, Noll DC, et al. Object orientation independence of susceptibility weighted imaging by using a sigmoid-type phase window. Proc Intl Soc Mag Reson Med. 2006;14:2399. 10. Reichenbach J, Haacke EM. High-resolution BOLD venographic imaging: a window into brain function. NMR Biomed. 2001;14:453-67. 11. Haacke EM, Makki M, Ge Y, et al. Characterizing iron deposition in multiple sclerosis lesions using susceptibility weighted imaging. J Magn Reson Imaging. 2009;29:537-44. 12. Schenck JF. The role of magnetic susceptibility in magnetic resonance imaging: MRI magnetic compatibility of the first and second kinds. Med Phys. 1996;23:815-50. 13. Wu Z, Mittal S, Kish K, et al. Identification of calcification with MRI using susceptibility-weighted imaging: a case study. J Magn Reson Imaging. 2009;29:177-82. 14. Bai Y, Wang MY, Han YH, et al. Susceptibility weighted imaging: a new tool in the diagnosis of prostate cancer and detection of prostatic calcification. PLoS One. 2013;8:e53237. 15. Zulfiqar M, Dumrongpisutikul N, Intrapiromkul J, et al. Detection of intratumoral calcification in oligodendrogliomas by susceptibility-weighted MR imaging. AJNR Am J Neuroradiol. 2012;33:858-64. 16. Zhu WZ, Qi JP, Zhan CJ, et al. Magnetic resonance susceptibility weighted imaging in detecting intracranial calcification and hemorrhage. Chin Med J (Engl). 2008;121:2021-5. 1. Mestre, Doutorando da Faculdade de Filosofia, Ciências e Letras de Ribeirão Preto da Universidade de São Paulo (FFCLRP-USP), Ribeirão Preto, SP, Brasil 2. Doutor, Professor da Faculdade de Medicina de Ribeirão Preto da Universidade de São Paulo (FMRP-USP), Ribeirão Preto, SP, Brasil 3. Doutor, Professor da Faculdade de Filosofia, Ciências e Letras de Ribeirão Preto da Universidade de São Paulo (FFCLRP-USP), Ribeirão Preto, SP, Brasil Endereço para correspondência: Jeam Haroldo Oliveira Barbosa Faculdade de Filosofia, Ciências e Letras de Ribeirão Preto, Universidade de São Paulo Avenida Bandeirantes, 3900, Monte Alegre Ribeirão Preto, SP, Brasil, 14040-901 E-mail: jeamharoldo@hotmail.com Recebido para publicação em 18/2/2014. Aceito, após revisão, em 5/8/2014. Trabalho realizado na Universidade de São Paulo - Programa de Pós-Graduação em Física Aplicada a Medicina e Biologia, Ribeirão Preto, SP, Brasil. Apoio financeiro: Fundação de Amparo à Pesquisa do Estado de São Paulo (Fapesp), Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq) e Coordenação de Aperfeiçoamento de Pessoal de Nível Superior (Capes). |
|
Av. Paulista, 37 - 7° andar - Conj. 71 - CEP 01311-902 - São Paulo - SP - Brazil - Phone: (11) 3372-4544 - Fax: (11) 3372-4554