Radiologia Brasileira - Publicação Científica Oficial do Colégio Brasileiro de Radiologia
AMB - Associação Médica Brasileira CNA - Comissão Nacional de Acreditação
 Vol. 48 nº 2 - Mar. / Abr. of 2015
Vol. 48 nº 2 - Mar. / Abr. of 2015
|
ARTIGO ORIGINAL
|
|
|
|
|
Autho(rs): Luiz Henrique Costa Garcia1; Bruna Cortez Ferreira2 |
|
|
Descritores: Cuidados intensivos; Neuroimagem; Medicina de emergência; Tomografia computadorizada; Lesão cerebral traumática; Hemorragia intracraniana. |
|
|
Resumo: INTRODUÇÃO
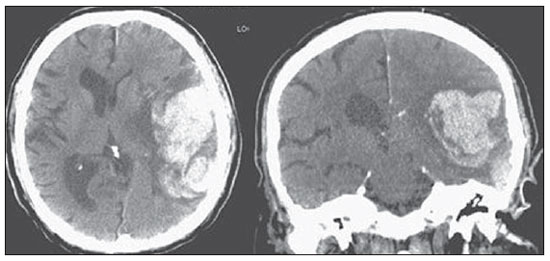
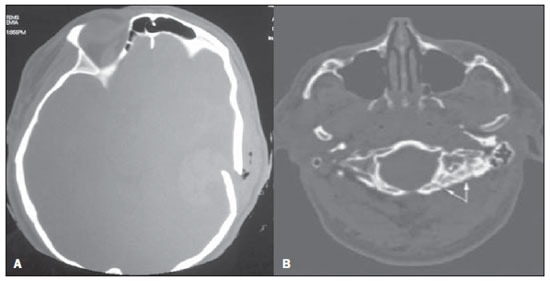
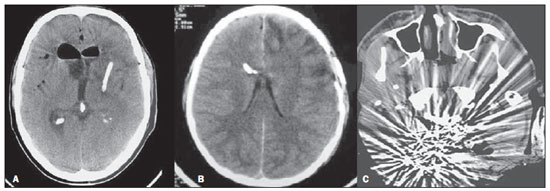
A tomografia computadorizada (TC) de crânio é um exame extremamente útil e de utilização comum, principalmente no ambiente de terapia intensiva, bem como na emergência da maioria dos hospitais, no Brasil e no mundo. É um exame amplamente disponível, ao contrário da ressonância magnética, sendo muitas vezes a modalidade de escolha de imagem inicial, tanto para o diagnóstico quanto para orientar o tratamento(1). As indicações da TC de crânio são as mais diversas: alterações na escala de coma de Glasgow; estado confusional agudo; aparecimento súbito de cefaleia intensa; trauma cranioencefálico grave; sonolência persistente; estado de mal epiléptico, pós-epiléptico com a diminuição do nível de consciência ou com déficit focal; lesão hipóxica cerebral (pósparada cardíaca)(2). Na urgência, a investigação cerebral de escolha é a TC de crânio, por ser não invasiva, amplamente disponível, de fácil e rápida utilização, além do custo relativamente baixo(3). Este exame consegue, por exemplo, distinguir entre acidente vascular cerebral (AVC) hemorrágico (AVCH) e isquêmico (AVCI), numa fase inicial, o que é determinante no prognóstico e tratamento. Após o evento hemorrágico, consegue-se visualizar rapidamente na TC, em razão da alta densidade do sangue, em comparação ao tecido cerebral. Entretanto, a TC tem baixa sensibilidade em demonstrar alteração isquêmica não hemorrágica nas primeiras horas após evento agudo(4-7). De longa data se sabe que a rapidez em formar diagnósticos permite rápido tratamento, com melhores desfechos. Além disso, muitas vezes os plantonistas, principalmente do plantão noturno, não são especialistas em neurologia/neurocirurgia, tampouco radiologistas, de modo que não possuem a expertise em interpretar a TC na urgência. Não bastasse isso, a maioria dos hospitais não possui esquema noturno de plantão na radiologia. Tem-se, então, um dilema: apesar do aumento constante no uso deste aparato tecnológico, quem vai interpretar as imagens? A rotina, na grande maioria dos hospitais, é que o próprio médico solicitante avalie o exame e, a partir dele, tome ou indique uma conduta. Os programas de treinamento médico têm cada vez mais incluído em seus assuntos o treinamento em radiologia. Analogamente, a interpretação do eletrocardiograma, que era inicialmente de domínio do cardiologista, é rotina para os médicos generalistas, que devem saber interpretá-lo. Não é, portanto, impraticável que o mesmo ocorra com a TC de crânio, pelo menos no que concerne a uma avaliação básica(8). A proposta deste trabalho é sistematizar a avaliação da TC de crânio, sinalizando os pontos principais a serem observados, com o escopo de orientar os médicos atuantes na emergência dos hospitais, bem como nas unidades de terapia intensiva. Para tanto, se propõe a avaliação sistematizada obedecendo-se a sequência ABCDEFG, seguindo o modelo utilizado, com sucesso, na avaliação da radiografia de tórax pelo Advanced Trauma Life Support (ATLS). Foi realizado estudo descritivo após revisão bibliográfica das seguintes bases de dados: Access Medicine e Access Emergency Medicine (McGraw-Hill Education); Bristish Medical Journal Evidence Center; UptoDate; Bireme; PubMed; Lilacs; SciELO; ProQuest; Micromedex (Thomson Reuters); Embase. Feita a revisão, identificaram-se as principais enfermidades de repercussão tomográfica e propôs-se uma sistematização da avaliação do exame. DISCUSSÃO As principais doenças de importância neurocirúrgica e clínica são: hemorragias intraparenquimatosa, subdural, subaracnoide e extradural; lesão axonal difusa; AVCs (isquêmicos ou hemorrágicos); edema cerebral; tumores; hidrocefalia e demais causas de dilatação de ventrículos e cisternas; traumatismo. A partir disso, propõe-se a sistemática baseada no ABC, adaptado do Advanced Cardiovascular Life Support (ACLS). Utilizou-se a língua inglesa com a finalidade de universalizar o uso dessa sistematização. A: ATTENUATION - avaliação da diferença de atenuação das substâncias branca e cinzenta, bem como das diferentes densidades do parênquima cerebral, procurando sinais de edema cerebral, AVC e tumores. B: BLOOD - avaliação da existência de sangramento em parênquima, cisternas e ventrículos, bem como a reação causada pela presença desse sangue, como desvio da linha média. Determina-se a natureza do sangramento, se intraparenquimatoso, extradural ou subdural. C: CAVITIES - avaliação das cavidades cranianas: ventrículos e cisternas. D: DILATION - avaliação de dilatação de ventrículos e cisternas, como complicação pós-operatória ou doença. E: EXTERIOR - avaliação da tábua óssea e tecido subcutâneo. F: FISHER SCALE - graduação de Fisher, no caso de hemorragia subaracnóidea; G: GHOSTS, DRAINS AND ARTIFACTS - identificação de drenos, cateteres e artefatos. Na TC de crânio postula-se: A: ATTENUATION - A TC captura imagens transversais mediante raios X e as reconstrói via computador. As imagens são formadas em uma escala de preto a branco, intermediada por escala de cinza, determinada pela densidade da estrutura e a quantidade de energia de raios X que passa através dele. A esse fenômeno dá-se o nome de atenuação do raio X. Esse grau de atenuação do feixe de imagem é quantificado e expresso em unidades Hounsfield (UH). Os valores de atenuação variam de - 1000 UH, correspondente a ar, até 3000 UH, correspondente a osso, tendo a água densidade de cerca de zero UH(9). Na TC de crânio, a atenuação de cada tecido se dá pela diferença de absorção mediante a diferenciação entre substância cinzenta e branca, de acordo com o conteúdo mielínico e, consequentemente, de gordura, de cada um. Gordura e ar têm baixos valores de atenuação e podem ser facilmente identificados. O líquido cefalorraquidiano (LCR) tem um valor de atenuação semelhante ao da água, aparecendo preto. Os diferentes processos patológicos podem se tornar aparentes em decorrência do edema em seu interior ou em estruturas adjacentes. O edema mostra-se menos denso que a estrutura adjacente(8). Nessa primeira etapa buscam-se diferenças de atenuação entre os tecidos, que possam sugerir evento isquêmico, edema ou massas. AVC é um evento comum e se divide em dois tipos, com causas diametralmente opostas: o AVCH, fruto de sangramento no interior da cavidade craniana, e o AVCI, que perfaz 80% dos AVCs, ocasionado por falta de suprimento sanguíneo e consequente oxigênio ao tecido cerebral. O AVCH, que será abordado a posteriori na avaliação B do presente estudo, pode ser subdividido em AVCH parenquimatoso (sangue no parênquima) e AVCH com hemorragia subaracnoide (sangue no LCR)(8). O cérebro enfartado é inicialmente pálido e, com o passar das horas e dias, a substância cinzenta torna-se edemaciada, com dilatação dos vasos sanguíneos e pequenas petéquias. Quando um êmbolo que ocluía um vaso sofre lise ou migra, há influxo sanguíneo para a área enfartada, podendo causar extravasamento de sangue e consequente transformação hemorrágica. Na maior parte, os AVCIs ocorrem por diminuição do fluxo sanguíneo cerebral gerando déficit de oxigênio e nutrientes para esse tecido. Outra gênese ocorre por oclusão das veias de drenagem, resultando em edema cerebral, e pode causar tanto a isquemia cerebral quanto a hemorragia. Há três subtipos principais de AVCI, quanto à causa: por trombose arterial decorrente de doenças da parede arterial por arteriosclerose, dissecção ou displasia fibromuscular; embólico, em que partículas provenientes de diversas partes do organismo migram para alguma região do cérebro; porém, como não é um processo restrito a uma área definida, terapia local só resolve o problema temporariamente; por hipoperfusão orgânica, ocasionado por déficit sanguíneo sistêmico, privando, por conseguinte, o tecido encefálico de sangue. Existe, ainda, a entidade nosológica denominada ataque isquêmico transitório, em que os sintomas neurológicos duram menos que 24 horas(10-12). A bibliografia demonstra níveis próximos de 60% de não detecção do AVC nas primeiras 12 horas, de modo que o exame é indicado, neste momento, para avaliação de possível sangramento. Um estudo, apenas com avaliação de TC nas primeiras 6 horas após os sintomas, obteve acurácia diagnóstica de 61%(4). Vale citar que, em casos de AVC de artéria cerebral média (ACM), a TC é anormal em até 75% dos casos, já nas primeiras 3 horas. Vemos um sinal hiperdenso, que representa um trombo intraluminal, na região da ACM (na fissura sylviana). Os primeiros sinais tomográficos de AVCI são: hipoatenuação do território da ACM, apagamento do núcleo lentiforme e do sulcamento cortical, hipoatenuação focal do parênquima, obscurecimento da fissura sylviana, hiperdensidade da ACM - vista em 30% a 40% dos pacientes por trombo no lúmen arterial (Figura 1) -, e perda da diferenciação cinza-branco nos gânglios da base (Figura 2). 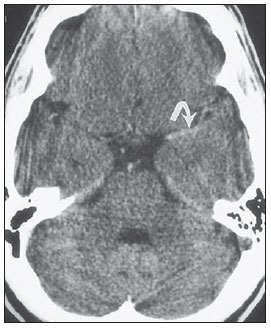 Figura 1. Seta mostra hiperdensidade da ACM. 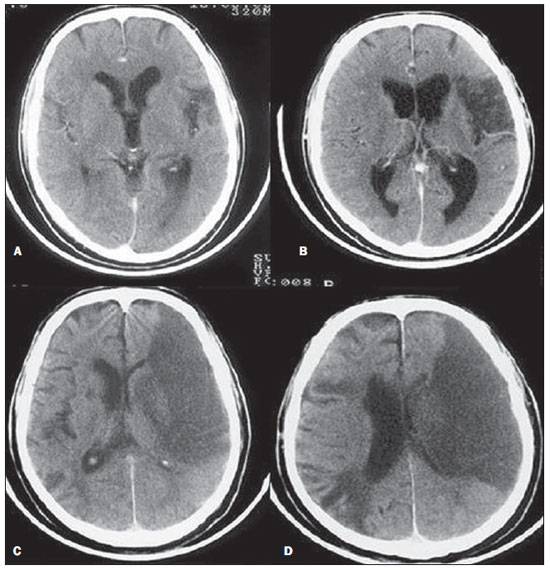 Figura 2. TC com AVCI do território da ACM. A,B: Infarto parcial, com envolvimento restrito ao hemisfério esquerdo. C,D: Infarto completo à esquerda, com efeito de massa comprimindo o ventrículo lateral. No hemisfério direito visualiza-se hipodensidade esquerda menor. Entre 12 e 24 horas há uma alteração na diferenciação branco-cinza normal, decorrente de edema. Após 24 horas, até o 7º dia, vê-se uma área de hipodensidade em uma distribuição vascular (em 70%), em razão de edema citotóxico. Pode ocorrer, inclusive, um efeito de massa com compressão total ou parcial de ventrículos e cisternas. A transformação hemorrágica pode ocorrer e demonstra-se, em 70% dos casos, entre o 2º e 4º dias. Com a diminuição do efeito de massa, se houver, pode-se observar dilatação ex-vácuo dos ventrículos. Mais tardiamente pode haver perda de massa de parênquima, com sulcamento associado e alargamento ventricular consequente a encefalomalácia(13,14). Em alguns casos já se pode visualizar sinais tomográficos com 6 horas dos sintomas de AVCI (Figura 3). 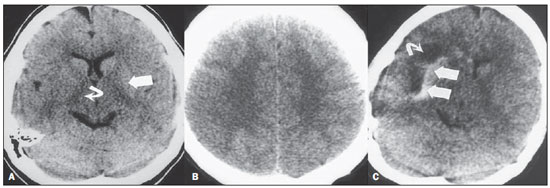 Figura 3. A: TC seis horas após os sintomas. A seta curva denota demarcação medial da porção posterior da cápsula interna direita. Nota-se que a margem lateral da cápsula interna direita é mal definida, pela diminuição da atenuação do núcleo lentiforme. A seta reta mostra a cápsula interna e o núcleo lentiforme esquerdos normais. B: Diminuição da diferenciação branco-cinza no hemisfério cerebral direito, correspondente à distribuição da ACM. C: Três dias após - área de maior atenuação (setas retas) correspondendo à hemorragia em uma região de infarto. As áreas não hemorrágicas de infarto são vistas como hipoatenuante (seta curva). B: BLOOD - Os sangramentos cerebrais importantes são as hemorragias - intraparenquimatosa, subaracnoide, subdural, extradural -, além da lesão axonal difusa. Hemorragia intracraniana responde por 15% de todos os AVCs, com a maior mortalidade, se comparada com os demais subtipos de AVC (até 50% nas primeiras 48 horas após o evento)(15). Atinge principalmente homens, hipertensos, usuários de trombolíticos e anticoagulantes, cocaína e anfetaminas, além de tabagistas e diabéticos(16). A localização do sangramento prediz o quadro clínico subjacente: por exemplo, hemorragias putaminais podem provocar desvio e/ou hemiparesia/plegia contralateral, afasia, negligência ou agnosia; hemorragias talâmicas podem causar afasia (lado dominante), negligência (lado não dominante), déficits sensoriais ou motores contralaterais; lesões de tronco encefálico podem originar coma, tetraparesia, nistagmo, hipertermia e padrões respiratórios anormais. Hemorragias cerebelares podem apresentar-se com ataxia e nistagmo. Sinais de pressão intracraniana elevada/hidrocefalia: apagamento completo do quarto ventrículo ou do aqueduto cerebral(17) (Figura 4). A hemorragia subaracnoide (HSA), com uma incidência anual nos EUA de 1/10.000, não é, nem de perto, o principal motivo de visita ao hospital, porém tem elevada morbimortalidade, e por isso o reconhecimento precoce e tratamento agressivo podem melhorar os resultados(18). Atinge mais mulheres e tem faixa etária média de 50 anos. Até 12% dos pacientes morrem antes de chegar aos hospitais e 50% morrem dentro de 6 meses, além de 33% a 66% dos sobreviventes terem grande déficit neurológico. HSA é o vazamento de sangue no espaço subaracnoide, cuja causa, em 75% dos casos, é ruptura de aneurisma, e em 25% se dá por malformações arteriovenosas, dissecção arterial cerebral, coagulopatias, síndrome moyamoya, aneurisma micótico, neoplasia, apoplexia pituitária, vasculopatia, tumor cerebral e utilização de fármacos simpaticomiméticos. Em razão do potencial devastador do diagnóstico errôneo e tardio, devemse tomar medidas rapidamente visando ao tratamento da HSA. Apesar de toda tecnologia disponível, 5% a 12% dos pacientes com sintomas sugestivos não são diagnosticados com HSA na primeira visita ao hospital após o evento(19). O primeiro exame a ser solicitado é a TC de crânio sem contraste, sendo estimada uma sensibilidade de 98% nas primeiras 12 horas dos sintomas (Figura 5). Nas 24 horas cai para 93%, com decréscimo rápido após e reabsorção completa ou quase nos primeiros 10 dias(20). 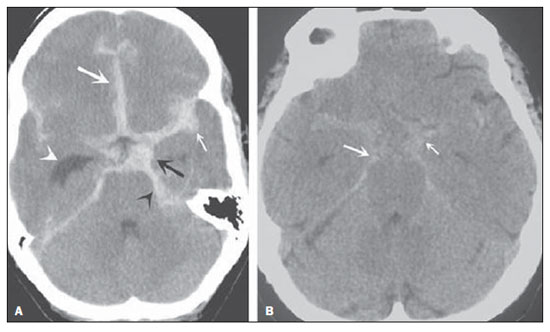 Figura 5. Em A nota-se hiperdensidade na cisterna suprasselar (seta preta), fissura inter-hemisférica (seta branca maior), cisterna cerebelopontina (cabeça de seta preta) e fissura sylviana (seta branca menor). Observa-se, ainda, hidrocefalia secundária no ventrículo lateral (cabeça de seta branca. Em B visualiza-se hiperdensidade moderada nos espaços suprasselares (seta menor) e cisternas perimesencefálicas (seta maior). Hemorragia subdural (HSD) é o sangramento entre a dura-máter e as membranas aracnoides. Atinge principalmente homens, entre 31 e 47 anos, resultando de trauma craniano fechado por acidentes automobilísticos, quedas e agressões. Há também o grupo com HSD crônica: idosos, pessoas com história de abuso crônico de álcool e as com lesão cerebral traumática anterior. É causada por ruptura das veias que drenam a partir da superfície do cérebro para os seios durais. A ruptura destes vasos provoca sangramento para o espaço entre as membranas dura-máter e aracnoide, sendo contido pelo aumento da pressão intracraniana ou compressão direta pelo próprio coágulo. Cerca de 20% a 30% ocorrem por ruptura arterial. Diminuição na pressão do LCR também pode gerar HSD, hipotensão essa por escoamento de LCR espontâneo ou após punção liquórica. Com a diminuição da pressão do LCR, há diminuição na flutuação do cérebro, causando tração sobre as estruturas de fixação e de apoio e consequente tração e ruptura dos vasos. Diferentemente do hematoma epidural (ou extradural), a HSD pode cruzar as margens suturais, porém limitada por processos subdurais, gerando uma lesão extra-axial em forma de crescente (Figura 6)(21,22). Essa entidade nosológica tem uma peculiaridade: está presente desde o momento da lesão em aproximadamente 50% dos casos, porém, cerca de 12% a 38% têm o "intervalo lúcido" após a lesão aguda (período no qual o paciente não tem nenhum sinal ou sintoma clínico da lesão, podendo evoluir com declínio neurológico progressivo até o coma). Eventualmente, por causa do aumento da pressão intracraniana ou efeito de massa, pode sobrevir hipoperfusão cerebral e consequente infarto, principalmente em HSD de fossa posterior, em razão da maior vulnerabilidade de compressão das artérias cerebrais posteriores ao longo da borda tentorial. Um estudo de 1988 identificou 91% de acurácia diagnóstica em HSD > 5 mm. Com a modernização da técnica de TC, estima-se acurácia ainda maior nos dias de hoje(23,24). 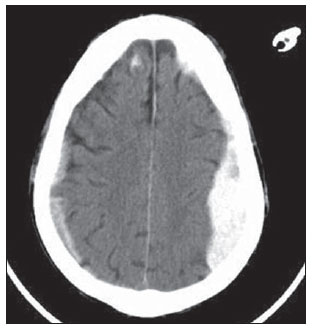 Figura 6. HSD à esquerda. Dentro das hemorragias, ainda temos o hematoma extradural ou epidural (HED), que resulta do acúmulo de sangue no espaço entre o crânio e a dura-máter. O principal mecanismo de lesão é o trauma contuso na região temporal ou temporoparietal, com uma fratura de crânio associada a ruptura da artéria meníngea média. Ocasionalmente, trauma na região parieto-occipital ou na fossa posterior gera lesão dos seios venosos com consequente HED. Classicamente, há um trauma contundente significativo com perda de consciência ou sensório alterado, seguido por um período lúcido e subsequente morte neurológica rápida. Na TC temos hemorragia biconvexa com alta densidade localizada na periferia da cavidade craniana. O HED cruza a reflexão subdural, mas não as suturas (ao contrário da HSD), e pode-se ter um efeito de massa e consequentes sinais de herniação e edema(2) (Figura 7). O sangramento arterial de alta pressão do HED pode provocar hérnia dentro de horas após a lesão, de modo que o reconhecimento precoce e a evacuação são vitais(25). 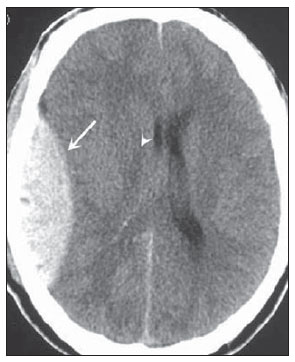 Figura 7. HED agudo demonstrado pelo formato de lente biconvexa (seta). Notase, também, diminuição da luz do ventrículo lateral direito associada a desvio da linha média (cabeça de seta), sugerindo herniação subfalcina. Lesão axonal difusa (LAD) é o rompimento de fibras axonais da substância branca e do tronco cerebral causado por força de cisalhamento sobre essas estruturas, fruto de desaceleração súbita. Classicamente, ocorre após trauma contuso (acidente de automóvel), podendo também ser vista em crianças (síndrome do bebê sacudido). Na LAD podemos observar formação rápida de edema, com déficits neurológicos devastadores e muitas vezes irreversíveis. A TC pode ser normal ou, classicamente, mostrar lesões hemorrágicas pontilhadas ao longo da junção cinza-branco do córtex cerebral e dentro das estruturas profundas do cérebro(26) (Figura 8). 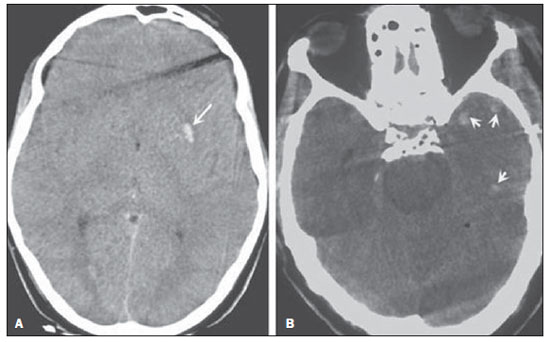 Figura 8. A imagem A demonstra LAD como foco de hiperdensidade na interface cinza-branco (seta). Em B, contusões com focos hiperdensos (setas) compatíveis com sangue no parênquima. C: CAVITIES - Avalia-se a patência dos ventrículos, cisternas, sulcos e fissuras. Essas estruturas geralmente se encontram repletas de LCR. O sistema ventricular é um sistema de comunicação de cavidades revestidas com epêndima e repletos de LCR. Temos dois ventrículos laterais, o terceiro ventrículo (entre as metades do diencéfalo), o aqueduto cerebral, e o quarto ventrículo dentro do tronco cerebral. Os ventrículos laterais são os maiores. Cada um inclui duas porções centrais (corpo e átrio) e três extensões (cornos). Os dois forames interventriculares, ou forames de Monro, são aberturas entre a coluna do fórnice e a extremidade anterior do tálamo. Os dois ventrículos laterais comunicam-se com o terceiro ventrículo por meio desses forames. O terceiro ventrículo é uma estreita fenda vertical entre as duas metades do diencéfalo. As paredes laterais são formadas principalmente pelas superfícies mediais dos dois tálamos. A parede lateral inferior e o piso do ventrículo são formados pelo hipotálamo; a comissura anterior e a lâmina terminal formam o limite rostral. O aqueduto cerebral é um estreito canal, curvo, que se dirige da porção posterior do terceiro ventrículo drenando no quarto ventrículo. O quarto ventrículo é uma cavidade em forma de pirâmide delimitada ventralmente pela ponte e medula espinhal, e seu piso também é conhecido como fossa romboide. O recesso lateral se estende por uma estreita faixa do ventrículo, na superfície dorsal do pedúnculo cerebelar inferior. O quarto ventrículo se estende sob o óbex para dentro do canal central da medula. O ponto em que o quarto ventrículo passa sobre o cerebelo é chamado de vértice ou fastigium. A posição do cerebelo, logo acima do teto do quarto ventrículo, tem implicações clínicas importantes. Lesões expansivas do cerebelo (por exemplo, tumores) ou edema cerebelar após acidente vascular podem comprimir o quarto ventrículo e gerar hidrocefalia obstrutiva aguda. A abertura lateral (forame de Luschka) é a abertura do recesso lateral no espaço subaracnoide perto do flóculo do cerebelo. Um tufo de plexo coroide está habitualmente presente na abertura e obstrui parcialmente o fluxo de LCR a partir do quarto ventrículo para o espaço subaracnoide. A abertura média (forame de Magendie) é uma abertura na parte caudal do teto do ventrículo. Grande parte da drenagem do quarto ventrículo é feita por esse forame. As cisternas são cavidades subaracnóideas repletas de LCR, que se comunicam entre si e com o espaço subaracnoide. Essas cisternas são mais bem visualizadas na ressonância magnética, mas podemos detectá-las na TC, na qual se mostram abertas normalmente. A cisterna magna é o espaço comum de LCR entre a medula e os hemisférios do cerebelo. A cisterna pontina localiza-se na face ventral da ponte e contém a artéria basilar e algumas veias. Abaixo do cérebro se encontra um espaço amplo entre os dois lobos temporais. Este espaço é dividido entre a cisterna quiasmática acima do quiasma, a cisterna suprasselar acima do diafragma selar, e a cisterna interpeduncular entre os pedúnculos cerebrais. O espaço entre os lobos frontal, parietal e temporal é chamado de cisterna da fissura lateral (cisterna de Sylvius)(27) (Figura 9). 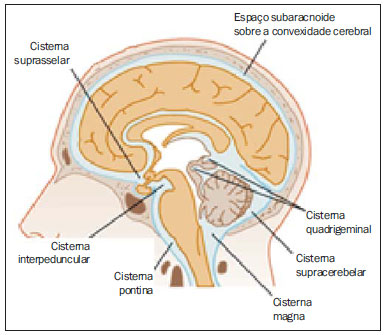 Figura 9. Cisternas. (Adaptado de Waxman(27)). Na prática, vistoriamos os ventrículos, se ausentes, presentes ou dilatados (perfazendo a avaliação seguinte D: DILATION). Também avaliamos presença ou ausência das cisternas, sendo a ausência dessas fruto de herniação encefálica ou edema cerebral grave(28). Os sulcos e fissuras separam os lobos frontal, parietal, occipital e temporais um do outro e da ínsula. A patência desses também pode estar comprometida na presença de outras enfermidades(29). D: DILATION - Neste ponto observamos existência de dilatação de ventrículos, o que sugere hidrocefalia. Antes da hidrocefalia doença, temos duas entidades clínicas que se mostram tomograficamente como hidrocefalia, porém sem aumento da pressão intracraniana. A primeira é a hidrocefalia ex-vácuo e a segunda é a hidrocefalia de pressão normal (HPN). Pode ser difícil diferenciar hidrocefalia de ventriculomegalia devida a atrofia cerebral (hidrocefalia ex-vácuo). As características seguintes são sugestivas de hidrocefalia, em vez de ventriculomegalia secundária a atrofia cerebral: alargamento dos recessos do terceiro ventrículo, dilatação dos cornos temporais do ventrículo lateral, edema intersticial dos tecidos, apagamento dos sulcos corticais(30) (Figura 10). 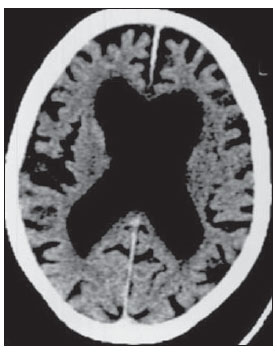 Figura 10. Hidrocefalia secundária a atrofia. Já a HPN caracteriza-se pelas manifestações clínicas da hidrocefalia (marcha anormal com ou sem incontinência urinária ou disfunção cognitiva), mas sem aumento significativo na pressão do LCR. Apesar disso, responde a uma redução na pressão do LCR e/ou de um procedimento de derivação. HPN é uma denominação confusa e enganadora, já que o termo "hidrocefalia" é geralmente usado para descrever a pressão do LCR elevada no cérebro, e aqui a pressão no sistema ventricular do cérebro não é considerada significativamente anormal(31). Na HPN a imagem pode ser normal ou mostrar evidências de alargamento ventricular ou leucomalácia periventricular (ou seja, os danos na substância branca em torno dos ventrículos cerebrais). Pode mostrar atrofia central, desproporcional, resultando em ventrículos maiores, com relativa preservação dos sulcos corticais no processo atrófico. Uma lesão obstrutiva exclui o diagnóstico(32). A hidrocefalia doença pode ser dividida em comunicante e não comunicante. A não comunicante (obstrutiva), mais prevalente, ocorre pelo fato de o LCR dos ventrículos não atingir o espaço subaracnoide, em razão de obstrução de um ou ambos os forames interventriculares, o aqueduto cerebral (o local mais comum de obstrução), ou os forames de saída do quarto ventrículo (aberturas mediana e lateral). Na hidrocefalia comunicante a obstrução é no espaço subaracnoide e pode ser o resultado de hemorragia prévia ou meningite, que gerou espessamento da aracnoide com obstrução dos ductos de drenagem (Tabela 1). Hidrocefalia pode ocorrer no pós-operatório de neurocirurgias, com incidência de 8% em ressecções tumorais. Resulta do derramamento de sangue no espaço subaracnoide ou ventrículos por causa de hemostasia inadequada ou de extensão da cirurgia em ventrículos. Pode ocorrer também em função de edema no sítio operatório, com consequente obstrução secundária dos locais de drenagem do LCR (especialmente quando a cirurgia é feita em torno do aqueduto ou forame de Monro). Também pode resultar de infecção do LCR no pós-operatório (isto é, ventriculites ou meningite). Pode ocorrer também entre duas e quatro semanas de pósoperatório, em consequência de aracnoidite progressiva causada por meningite asséptica/bacteriana ou mesmo hemorragia subaracnoide resultante de aneurisma. Por conta disso, alguns serviços têm como protocolo a realização de TC pósoperatória de rotina, uma vez que muitos pacientes retornam do centro cirúrgico intubados e sedados(27). E: EXTERNAL - Avaliamos tábua óssea e, consequentemente, fraturas dos ossos cranianos, incluindo-se a fratura de base de crânio. O trauma contuso ou penetrante na cabeça pode causar danos ao couro cabeludo ou até mesmo ao osso. A fratura de crânio pode ser aberta ou fechada (com e sem solução de continuidade da pele, respectivamente). As linhas de fratura podem ser simples (linear), múltipla e irradiar de um ponto (estreladas), ou múltiplas, criando fragmentos de osso (triturado). Fraturas da base do crânio são comuns em pacientes com cinemática de trauma significativa (Figura 11). São geralmente visíveis na TC sem contraste. Eventualmente, pode-se também observar hematoma subgaleal(33,34). F: FISHER SCALE - Nos casos de hemorragia subaracnoide lançamos mão da escala tomográfica de Fisher, com base na quantidade e distribuição de hemorragia, que ajuda a prever o risco de vasoespasmo. Há uma versão mais recente desta escala, a escala de Fisher modificada, que fornece um valor qualitativo para a presença de sangue intraventricular bilateral e nas cisternas, predizendo maior risco de vasoespasmo(35,36) (Tabela 2).  G: GHOSTS, DRAINS AND ARTIFACTS - Algumas doenças requerem drenagem e, consequentemente, a tomografia acusa a presença de dreno. Também é necessária monitoração invasiva mediante cateteres, como é o caso do cateter de pressão intracraniana (Figura 12). Artefato é a impressão visual da imagem de um recurso que, na realidade, não existe no tecido examinado. É importante reconhecê-lo para não ser confundido com doença. Pode ocorrer por mau funcionamento do digitalizador, movimento do paciente e presença de corpo estranho. Artefatos de movimento tendem a resultar em padrões de raio. Nos artefatos metálicos, cujo coeficiente de atenuação é muito maior que o de qualquer estrutura interna, o resultado é a perda da definição das estruturas adjacentes(8). Por exemplo, paciente com traumatismo craniano na década de 40, que exigia placa metálica na região frontal esquerda, a TC mostra artefato significativo causado pela placa metálica(37). CONCLUSÃO Ao se sistematizar uma atividade, diminui-se a chance de se cometerem equívocos, assim como de deixar passar lesões que deveriam ser vistas. Além disso, não há disponibilidade de especialistas para discutir o exame em 100% dos hospitais, muito menos, 24 horas por dia. Diante do exposto, ao se propor um método de fácil utilização e memorização, o trabalho de médicos intensivistas e emergencistas é facilitado, com menores chances de erros. Agradecimentos Aos doutores Uri Adrian Prync Flato, Daniela Pino Vinho, Fabiano Hirata e Roberto Marcó, e a todos os assistentes da Irmandade da Santa Casa de Misericórdia de São Paulo. REFERÊNCIAS 1. Grossman RI. Head trauma. In: Yousem DM, editor. Neuroradiology: the requisites. 2nd ed. Philadelphia: Mosby; 2003. p. 243. 2. Krishnam MS, Curtis J. Emergency radiology. Cambridge: Cambridge University Press; 2010. 3. John C, Elsner E, Müller A, et al. Computed tomographic diagnosis of acute cerebral ischemia. Radiologe. 1997;37:853-8. 4. Marks MP, Holmgren EB, Fox AJ, et al. Evaluation of early computed tomography findings in acute ischemic stroke. Stroke. 1999;30:389-92. 5. Pressman BD, Tourje EJ, Thompson JR. An early CT sign of ischemic infarction: increased density in a cerebral artery. AJR Am J Roentgenol. 1987;149:583-6. 6. von Kummer R, Allen KL, Holle R, et al. Acute stroke: usefulness of early CT findings before thrombolytic therapy. Radiology. 1997;205:327-33. 7. Scarabino T, Salvolini U, Jinkins JR. Emergency neuroradiology. Berlin: Springer; 2006. 8. Holmes EJ, Forest-Hay AC, Misra RR. Interpretation of emergency head CT: a practical handbook. Cambridge: Cambridge University Press; 2008. 9. Roper W, Abbuhl S. Computed tomography. In: Tintinalli JE, Stapczynski JS, Ma OJ, et al., editors. Tintinalli's emergency medicine: a comprehensive study guide. 7th ed. New York: McGraw-Hill; 2011. e299.2. 10. Caplan LR. Intracranial branch atheromatous disease: a neglected, understudied, and underused concept. Neurology. 1989;39:1246-50. 11. Caplan LR. Basic pathology, anatomy, and pathophysiology of stroke. In: Caplan LR, editor. Caplan's stroke: a clinical approach. 4th ed. Philadelphia: Saunders Elsevier; 2009. p. 22. 12. Caplan LR, Manning WJ. Brain embolism. New York: Informa Healthcare; 2006. 13. Beauchamp NJ Jr, Barker PB, Wang PY, et al. Imaging of acute cerebral ischemia. Radiology. 1999;212:307-24. 14. Tomandl BF, Klotz E, Handschu R, et al. Comprehensive imaging of ischemic stroke with multisection CT. Radiographics. 2003;23:565-92. 15. Broderick J, Connolly S, Feldmann E, et al. Guidelines for the management of spontaneous intracerebral hemorrhage in adults: 2007 update: a guideline from the American Heart Association/American Stroke Association Stroke Council, High Blood Pressure Research Council, and the Quality of Care and Outcomes in Research Interdisciplinary Working Group. Stroke. 2007;38:2001-23. 16. Ariesen MJ, Claus SP, Rinkel GJ, et al. Risk factors for intracerebral hemorrhage in the general population: a systematic review. Stroke. 2003;34:2060-5. 17. Barrocas AM, Longenecker BA. Intracranial hemorrhage. In: Farcy DA, Chiu WC, Flaxman A, et al., editors. Critical care emergency medicine. New York: McGraw-Hill; 2012. p. 285-92. 18. Wojak JC, Flamm ES. Intracranial hemorrhage and cocaine use. Stroke. 1987;18:712-5. 19. Schievink WI. Intracranial aneurysms. N Engl J Med. 1997;336:28-40. 20. Al-Shahi R, White PM, Davenport RJ, et al. Subarachnoid hemorrhage. BMJ. 2006;333:235-40. 21. Besenski N. Traumatic injuries: imaging of head injuries. Eur Radiol. 2002;12:1237-52. 22. Koç RK, Akdemir H, Oktem IS, et al. Acute subdural hematoma: outcome and outcome prediction. Neurosurg Rev. 1997;20:239-44. 23. Victor M, Ropper A. Craniocerebral trauma. In: Victor M, Ropper A, editors. Adams and Victor's principles of neurology. 7th ed. New York: McGraw-Hill; 2001. p. 925-53. 24. Gentry LR, Godersky JC, Thompson B, et al. Prospective comparative study of intermediate-field MR and CT in the evaluation of closed head trauma. AJR Am J Roentgenol. 1988;150:673-82. 25. Wright DW, Merck LH. Head trauma in adults and children. In: Tintinalli JE, Stapczynski JS, Ma OJ, et al., editors. Tintinalli's emergency medicine: a comprehensive study guide. 7th ed. New York: McGraw-Hill; 2011. [acessado em 25 de junho de 2013]. Disponível em: http://accessmedicine.mhmedical.com/content.aspx?bookid=348&Sectionid=40381742. 26. King WJ, MacKay M, Sirnick A; Canadian Shaken Baby Study Group. Shaken baby syndrome in Canada: clinical characteristics and outcomes of hospital cases. CMAJ. 2003;168:155-9. 27. Waxman SG. Ventricles and coverings of the brain. In: Waxman SG, editor. Clinical neuroanatomy. 26th ed. New York: McGraw-Hill; 2010. p. 149-62. 28. Sinagra A, Pérez M, Acuña M. Tercer ventrículo. Endoneuroanatomía de las estructuras adyacentes. Revista Argentina de Anatomía Online. 2010;1:16-20. 29. Waxman SG. Cerebral hemispheres/telencephalon. In: Waxman SG, editor. Clinical neuroanatomy. 26th ed. New York: McGraw-Hill; 2010. p. 131-47. 30. Schwartz DT. Hydrocephalus - use of CT before LP. In: Schwartz DT, editor. Emergency radiology: case studies. New York: McGraw-Hill; 2008. p. 487-96. 31. INPH Guidelines Study Group. Guidelines for the diagnosis and management of idiopathic normal-pressure hydrocephalus. Neurosurgery. 2005;57(Suppl 3):S1-52. 32. Ropper AH, Samuels MA. Disturbances of cerebrospinal fluid and its circulation, including hydrocephalus, pseudotumor cerebri, and low-pressure syndromes. In: Ropper AH, Samuels MA, editors. Adams and Victor's principles of neurology. 9th ed. New York: McGraw-Hill; 2009. p. 591-5. 33. Smith ML, Bauman JA, Grady MS. Neurosurgery. In: Brunicardi FC, Andersen DK, Billiar TR, et al., editors. Schwartz's principles of surgery. 9th ed. New York: McGraw-Hill; 2010. p. 1515-56. 34. Koizumi H, Suzuki S, Utsuki S, et al. A case of non-traumatic subgaleal hematoma effectively treated with endovascular surgery. Interv Neuroradiol. 2010;16:317-21. 35. Vivancos J, Gilo F, Frutos R, et al. Guía de actuación clínica en la hemorragia subaracnoidea. Sistemática diagnóstica y tratamiento. Neurología. 2014;29:353-70. 36. Novelline RA, Rhea JT, Rao PM, et al. Helical CT in emergency radiology. Radiology. 1999;213:321-39. 37. Hackett MT, Shih WJ, Kiefer VH. Brain SPECT artifacts in patients having metallic cranioplasty. J Nucl Med Technol. 2001;29:189-92. 1. Cirurgião Geral, Especialista em Medicina Intensiva pela Associação de Medicina Intensiva Brasileira (AMIB) e Irmandade da Santa Casa de Misericórdia de São Paulo, São Paulo, SP, Brasil 2. Médica Residente de Clínica Médica do Hospital de Base de São José do Rio Preto, São José do Rio Preto, SP, Brasil Endereço para correspondência: Dr. Luiz Henrique Costa Garcia Rua Frederico Straube, 600, Casa 13, Vila Oliveira Mogi das Cruzes, SP, Brasil, 08790-310 E-mail: luiz_mogi@yahoo.com.br Recebido para publicação em 1/7/2013. Aceito, após revisão, em 7/2/2014. Trabalho realizado na Irmandade da Santa Casa de Misericórdia de São Paulo, São Paulo, SP, Brasil. |
|
Av. Paulista, 37 - 7° andar - Conj. 71 - CEP 01311-902 - São Paulo - SP - Brazil - Phone: (11) 3372-4544 - Fax: (11) 3372-4554