Radiologia Brasileira - Publicação Científica Oficial do Colégio Brasileiro de Radiologia
AMB - Associação Médica Brasileira CNA - Comissão Nacional de Acreditação
 Vol. 48 nº 4 - Jul. / Ago. of 2015
Vol. 48 nº 4 - Jul. / Ago. of 2015
|
ARTIGO ORIGINAL
|
|
|
|
|
Autho(rs): José Hermes Ribas do Nascimento1; Ricardo Bernardi Soder2; Matias Epifanio3; Matteo Baldisserotto4 |
|
|
Descritores: Esteatose; Ultrassom; Obesidade; Adolescência. |
|
|
Resumo: INTRODUÇÃO
Vários fatores têm estimulado o desenvolvimento e aprimoramento de pesquisas para métodos não invasivos no diagnóstico da doença hepática gordurosa não alcoólica (DHGNA), questão esta de grande interesse na medicina(1). Nas últimas décadas, em razão do aumento nas taxas de prevalência do sobrepeso e da obesidade, justifica-se o grande aumento da DHGNA como a principal causa de doença hepática na população pediátrica no mundo(2-4). Casos de DHGNA que podem progredir para doença mais grave, como esteato-hepatite, cirrose e hepatocarcinoma, têm aumentado drasticamente nos Estados Unidos, com estimativa de 80 milhões a 100 milhões de americanos afetados(5-9). Na Europa, os casos têm aumentado em torno de 10% a 40% nos últimos 10 anos(10). Estudos sobre a obesidade infantil, que utilizaram parâmetros clínicos, bioquímicos e ultrassonográficos para graduação da infiltração gordurosa do fígado, registraram prevalência de esteatose hepática entre 53% e 77%(11,12). Sabe-se que a prevalência e gravidade da DHGNA estão ligadas a fatores étnicos, com aumento na população de crianças mexicano-americanas e nos povos de origem hispânica, em relação a outros grupos étnicos(13). A esteatose hepática é um termo amplo que denota acúmulo de lipídios, especialmente triglicerídeos, no citoplasma dos hepatócitos, excedendo 5% do peso do fígado(14,15). A DHGNA compreende um grande espectro de variações, em que a esteatose é a parte fundamental da doença, podendo progredir para fibrose em até 41% dos casos segundo vários estudos(7,16,17). Não há, atualmente, marcadores específicos bioquímicos ou testes sorológicos para o diagnóstico da DHGNA, sendo o método mais acurado a biópsia hepática, que fornece importantes informações sobre o grau do comprometimento hepático e sobre as mudanças globais na arquitetura do fígado, assim como avalia a gravidade da atividade do processo inflamatório e da fibrose(18). Entretanto, em razão da natureza invasiva da biópsia hepática, esta não pode ser utilizada para rastreamento populacional em grande escala, nem mesmo para acompanhamento dos pacientes após o tratamento, devido aos riscos do procedimento(19). Até o momento, várias técnicas de imagem têm sido usadas para a detecção da esteatose hepática: o ultrassom (US), a tomografia computadorizada (TC), a ressonância magnética (RM) e a RM com espectroscopia(19,20). A TC apresenta boa acurácia, com diagnóstico semiquantitativo, no entanto, seu uso para monitoração da resposta ao tratamento é limitado devido ao uso de radiação ionizante(21). A RM é, atualmente, a mais acurada das técnicas, detectando quantidade de gordura inferior a 0,5%, porém, apresenta algumas limitações - o tempo prolongado para a rotina clínica, o alto custo do exame, requer experiência do operador, processamento de dados e interpretação dos resultados -, tornando-se seu uso limitado na prática clínica para estudos populacionais e monitoramento de tratamento(21,22). O US é de baixo custo, no entanto, utiliza uma análise subjetiva na avaliação da esteatose, ou seja, não fornece dados quantitativos, e com isso a sua sensibilidade é reduzida em até 60%, especialmente em pacientes obesos ou nos com pouca infiltração gordurosa no fígado(12,23). Recentemente, Soder et al. descreveram uma nova técnica para o diagnóstico da DHGNA, utilizando o US com análise computadorizada, semiquantitativa, com o cálculo do gradiente hepatorrenal, que apresentou ótimos resultados em crianças obesas e eutróficas(24), mas esta técnica não foi comparada com nenhum outro método de imagem. Salientamos que até o momento não foram realizados estudos clínicos comparando a acurácia do gradiente hepatorrenal ultrassonográfico computadorizado no diagnóstico da DHGNA, com a RM, que é o padrão ouro, em análise de imagem. Pelo fato de o US com análise computadorizada ser um método reprodutível, acessível e de baixo custo para avaliação da DHGNA, o presente estudo visa comparar a acurácia do US com análise computadorizada mediante cálculo do gradiente hepatorrenal, com a quantificação obtida por meio da RM, na investigação da DHGNA em adolescentes obesos e eutróficos, com o objetivo de validar a primeira técnica. MATERIAIS E MÉTODOS População em estudo Estudo transversal prospectivo realizado no período de outubro de 2011 a fevereiro de 2012, com 50 adolescentes (idades de 11 a 17 anos). Um grupo de 24 adolescentes obesos, atendidos em um ambulatório de nutrição, e outro grupo de 26 estudantes adolescentes eutróficos, voluntários de uma escola estadual, foram convidados a participar do estudo. A pesquisa foi aprovada pelo comitê de ética da Instituição e obtido o consentimento informado por escrito de todos os pais ou responsáveis legais dos adolescentes. Foram excluídos do estudo todos os adolescentes com doença hepatorrenal, em uso de drogas hepatotóxicas, nefrotóxicas, corticosteroides, agentes imunossupressores ou com outras doenças crônicas. Os adolescentes foram submetidos a exames de US, RM, laboratoriais e avaliação antropométrica. Os pacientes selecionados foram examinados por nutricionista com experiência de 10 anos e título de especialista. O médico coordenador desta equipe multidisciplinar fez a solicitação dos exames laboratoriais, que foram obtidos em até uma semana após a realização das medidas antropométricas, US e RM. Os exames de US com análise computadorizada foram realizados por médico radiologista com longa experiência na área de radiologia abdominal, com título de especialista equivalente ao americano, em aparelho Voluson (GE Healthcare; Milwaukee, EUA). No mesmo dia, foram realizados os exames de RM, em aparelho Signa Excite (GE Healthcare; Milwaukee, EUA) com magneto de 1,5 T, com bobinas de superfície phased array, bobinas array de coluna, com quatro canais. Medidas antropométricas As informações sobre sexo, idade, peso, estatura e circunferência abdominal foram coletadas. Foi utilizada a tabela de índice de massa corpórea (IMC) versus idade, do National Center for Health Statistics, para acessar o percentil de cada adolescente. Para comparar o IMC nas diferentes idades e sexos, foi calculado o Z score. O Z score representa o número de desvios-padrão acima e abaixo dos valores médios da população na infância e adolescência. Para a análise da obesidade foi utilizado o IMC igual ou maior que o percentil 97, e para o grupo dos eutróficos foi empregado o IMC entre os percentis 25 e 75. O IMC foi calculado com o peso (kg) dividido pela altura elevada ao quadrado (m2). Para comparar o IMC nas diferentes idades e sexos, o Z score foi calculado, sendo diagnóstico de obesidade o escore-z > +2. Técnica do US hepático com análise computadorizada Os exames ultrassonográficos foram realizados em tempo real e em escala de cinza, com transdutor convexo de 3,5-5 MHz, usando uma plataforma GE, com parâmetros de imagem ajustados para todos os adolescentes examinados. Para cada paciente foram obtidas duas imagens representativas do parênquima hepático e do córtex renal direito, utilizando abordagem subcostal, na linha hemiclavicular. As imagens foram compostas pelo segmento hepático VI e pelo parênquima renal adjacente, obtidas na área do espaço hepatorrenal, durante inspiração máxima. Após a digitalização das imagens, que foram adquiridas em formato DICOM, foi utilizado o software Image J para a análise computadorizada, que mede a ecogenicidade da imagem digital obtida pelo US. Este software foi empregado para a quantificação da ecogenicidade do parênquima hepático e do córtex renal direito, sendo seus valores graduados em escala de cinza, variando de 0 até 255, do preto ao branco, respectivamente. Foram selecionadas duas regiões de interesse (ROIs) com formato circular, descritas a seguir: parênquima hepático, próximo de sua borda inferior (área de 400-500 pixels), e córtex renal direito, próximo de sua borda superior (área de 300-400 pixels), selecionadas de maneira justaposta e no mesmo eixo do feixe acústico, a fim de minimizar artefatos e variações na ecogenicidade da janela acústica, método este já descrito por Soder et al.(24,25). Após a mensuração da ecogenicidade nas ROIs, os dois valores resultantes foram subtraídos para obtenção do gradiente hepatorrenal ultrassonográfico (GHRU). Esse protocolo foi aplicado para todos os adolescentes incluídos no estudo, obesos e eutróficos (Figura 1). 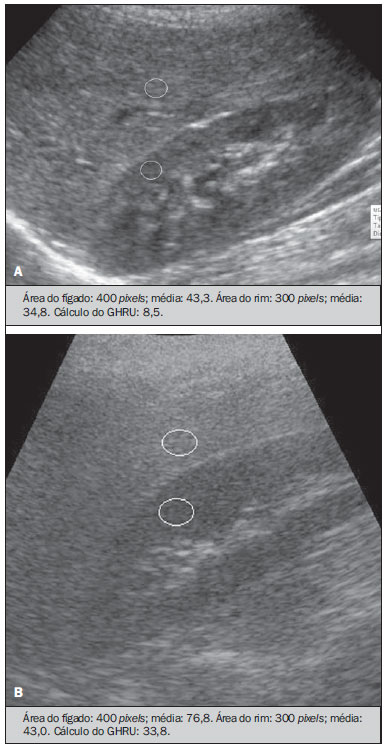 Figura 1. Imagens ultrassonográficas demonstrando as regiões de interesse. A: US do fígado em adolescente eutrófico. Gradiente hepatorrenal (sem esteatose). B: US do fígado em adolescente obeso. Gradiente hepatorrenal (com esteatose). As imagens foram gravadas em formato DICOM e analisadas por dois médicos radiologistas, para ver a concordância dos valores. Técnica de RM hepática As imagens hepáticas dos pacientes eutróficos e obesos foram obtidas em aparelho de RM 1,5 T, com a plataforma GE. A aquisição das imagens foi realizada com plano axial no final da expiração, em apneia, para reduzir de forma global o tempo de aquisição para aproximadamente 15 s. Para o cálculo da fração de gordura (FG) foi utilizado o método de dois pontos de Dixon modificado por Fishbein et al.(23), já descrito no trabalho de Pacifico et al.(25). Este método é baseado na mudança de fase da imagem, em que a FG é calculada pela diferença de sinal entre dois vetores, resultantes do sinal em fase e fora de fase (Tabela 1). 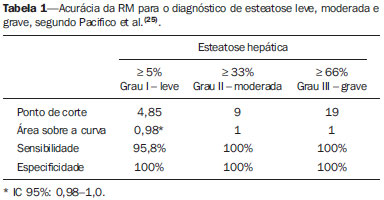 Os parâmetros para múltiplas sequências de aquisições ponderadas em T1 gradiente eco foram os seguintes: tempo de repetição de 174 ms; tempo de eco de 2,1 ms para imagens fora de fase e 4,9 ms para sinais em fase; campo de visão de 35 cm × 40 cm; espessura do corte de 5 mm; flip angle de 70º; tamanho da matriz de 256 × 182. Pixels para a intensidade do sinal em fase e fora de fase foram obtidos para selecionar as ROIs. Os valores da intensidade do sinal para o fígado e baço foram adquiridos em fase e fora de fase, com uma média circular das ROIs de 1 cm2(25,26). A gordura hepática foi quantificada como a porcentagem relativa de perda de intensidade do sinal do fígado nas imagens fora de fase, pela seguinte fórmula: 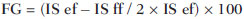 onde: IS é a média da intensidade do sinal do fígado dividida pela média da intensidade do sinal do baço; IS ef e IS ff são as intensidades dos sinais em fase e fora de fase, respectivamente. A intensidade do sinal do baço foi usada como um denominador na fórmula, para ajustar a falta de uma objetiva escala de intensidade do sinal para a RM, método usado por Pacifico et al.(25-27). Foram determinadas as ROIs no segmento VI do fígado, próximo à cortical renal, correspondente ao mesmo segmento efetuado no US, com o cuidado de evitar áreas de vasos, artefatos de movimento e efeito de volume parcial. Medidas similares do baço foram realizadas e a média da intensidade do sinal foi calculada para as ROIs do fígado (Figura 2). 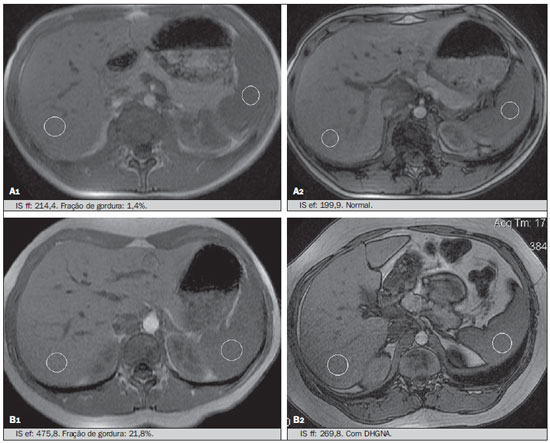 Figura 2. A: Imagens de RM de adolescente sem esteatose demonstrando a intensidade de sinal (IS), em fase (ef) e fora de fase (ff), chemical shift, e as ROIs. B: Imagens de RM de paciente com esteatose demonstrando a intensidade de sinal (IS), em fase (ef) e fora de fase (ff), chemical shift, e as ROIs. Análise estatística Os dados foram registrados, demonstrados em forma de gráficos e tabelas, e então analisados empregando-se métodos estatísticos, armazenados em planilha Excel. Foi utilizado o programa estatístico SPSS (Statistical Package for the Social Sciences), versão 18.0. Dados contínuos foram apresentados por média e desvio-padrão (caso distribuição simétrica) ou mediana e amplitude interquartílica (caso distribuição assimétrica). Dados categóricos foram apresentados na forma de frequências absolutas e proporções. Para avaliar a concordância interobservadores foi utilizado o teste de Friedman, complementado pelo coeficiente de correlação intraclasse. Para avaliar a concordância intraobservadores foi utilizado o teste de Wilcoxon, também complementado pelo coeficiente de correlação intraclasse. Diferenças entre médias foram avaliadas pelo teste t de Student para variáveis com distribuição normal, e pelo teste de Mann-Whitney em caso de distribuição anormal. Na avaliação das variáveis categóricas foi aplicado o teste qui-quadrado. Para avaliar as propriedades diagnósticas do gradiente ultrassonográfico foram calculados a sensibilidade, a especificidade, os valores preditivos positivos e negativos e a acurácia, seguindo a posterior geração de curva receiver operating characteristic (ROC) e cálculo da área sob a curva estabelecida, para determinar o melhor ponto de corte para o gradiente hepatorrenal, para predizer graus de esteatose, utilizando os resultados da RM como padrão ouro. Os pontos de corte escolhidos priorizaram a minimização de valores falso-positivos e falso-negativos. O valor p < 0,05 foi considerado como sendo estatisticamente significante. Cálculo do tamanho amostral Para fins de cálculo de tamanho amostral foram utilizados dados de estudos prévios que avaliaram a acurácia e quantificaram a gordura na infância por meio da RM(13,24,28). Com base nesses estudos, adotando a FG estimada por RM e o gradiente aferido por US, para um coeficiente de correlação linear (r de Pearson) da ordem de 0,5, nível de significância de 5% e poder estatístico de 90%, são necessários 50 indivíduos(5,24). RESULTADOS No grupo dos obesos havia 7 meninas (29,2%) e 17 meninos (70,8%), e no grupo dos eutróficos, 18 meninas (69,2%) e 8 meninos (30,8%). As médias das idades dos obesos e eutróficos foram 14,2 anos (± 2; 11-17 anos) e 14,7 anos (± 2; 12-17anos), respectivamente. O grupo de obesos apresentou uma proporção significativamente maior de meninos em comparação com o grupo de eutróficos (p = 0,011). A proporção de circunferência abdominal elevada foi estatisticamente significante entre os grupos de eutróficos e de obesos, respectivamente (15,4% versus 95,8%; p < 0,001). No presente estudo foram encontrados 5 (19,2%) indivíduos eutróficos com esteatose e 20 (83%) obesos com esteatose. A prevalência de esteatose nos obesos foi significativamente maior (83,3%; IC 95%: 64,5-94,5) do que nos eutróficos (19,2%; IC 95%: 7,4-37,6). Após a análise do GHRU, que foi calculado pela diferença de ecogenicidade entre a cortical do fígado e a ecogenicidade do parênquima renal, observou-se diferença significativa entre a mediana dos adolescentes obesos e dos eutróficos (mediana = 19,5; P25 = 15,5; P75 = 28 versus mediana: 10,0; P25 = 8; P75 = 11; p < 0,001). No entanto, ao se dividir os adolescentes entre com e sem esteatose e se reavaliar a diferença entre obesos e eutróficos, não há diferença significativa entre eles (com esteatose: p = 0,818; sem esteatose: p = 0,971) (Figura 3). 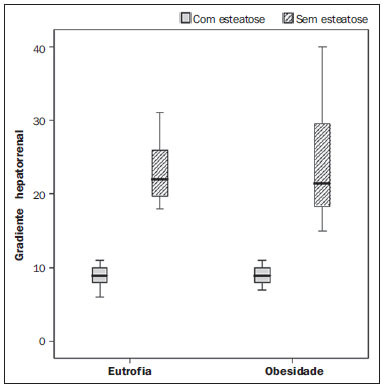 Figura 3. Box plot dos valores (níveis) dos gradientes entre os dois grupos, em indivíduos com e sem esteatose. A linha central dentro da caixa representa a mediana. Os limites superior e inferior da caixa representam, respectivamente, os percentis 75 e 25. As barras de erro superior e inferior representam a mediana ± 1,5 (P75–P25). Foi observada, também, diferença significativa entre as medianas dos adolescentes com e sem esteatose (mediana = 22; P25 = 18,5; P75 = 29,5 versus mediana = 9; P25 = 7,8; P75 = 10; p < 0,001). A curva ROC gerada para o gradiente hepatorrenal está demonstrada na Figura 4, com ponto de corte de 13, com sensibilidade de 100% e especificidade de 100% (Tabela 2). Considerando esse mesmo ponto de corte para os eutróficos, haveria 9,5% de falso-positivos (especificidade = 90,5%) e 0% de falso-negativos (sensibilidade = 100%). 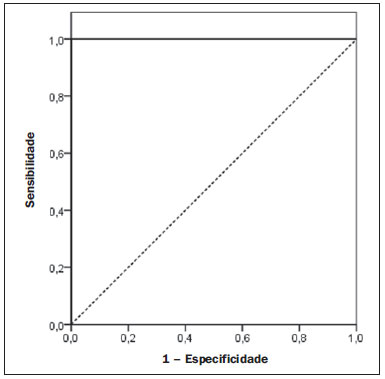 Figura 4. Curva ROC na avaliação do ponto de corte do GHRU, considerando a RM como padrão ouro na esteatose. 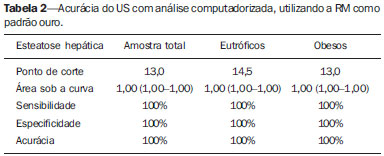 Após análise computadorizada das imagens digitais, não foram encontradas diferenças estatisticamente significantes entre os valores da ecogenicidade do parênquima hepático dos obesos e dos eutróficos (87,6 ± 25,5 versus 82,5 ± 32; p = 0,535), assim como não foi encontrada diferença estatisticamente significante entre a ecogenicidade renal dos dois grupos (67,3 ± 31,2 versus 73,9 ± 32,5; p = 0,466). Validação da técnica de US com análise computadorizada Os exames de US realizados em 50 pacientes que participaram da pesquisa foram separados de forma aleatória e reavaliados por três médicos radiologistas com mais de 10 anos de experiência em radiologia abdominal, para o cálculo do GHRU. Os resultados dos exames ultrassonográficos do estudo validaram o GHRU, demonstrando que não houve diferença significativa entre os três avaliadores (teste de Friedman; p = 0,100), e com alto coeficiente de correlação intraclasse (ICC = 0,95; IC 95%: 0,90-0,98). Também não houve diferença entre as duas avaliações do mesmo observador (teste de Wilcoxon; p = 0,275), e com elevado coeficiente de correlação intraclasse (ICC = 0,97; IC 95%: 0,93-0,99). DISCUSSÃO A avaliação por métodos de imagem, particularmente por ultrassonografia, do fígado e do trato biliar tem sido motivo de uma série de publicações recentes na literatura radiológica nacional(29-34). Foi demonstrado, no presente estudo, que a prevalência da DHGNA foi 19,2% no grupo dos eutróficos e 83% no grupo dos obesos, semelhante à do trabalho de Chan et al., que encontraram prevalência de esteatose hepática entre 53% e 77%(12). No entanto, em estudo de Pacifico et al., realizado em 55 crianças italianas obesas, registrou-se prevalência de esteatose de 40%, diagnosticada pela RM(28). Segundo Devadason et al., em ampla pesquisa de revisão sobre a DHGNA e esteato-hepatite não alcoólica, foram encontrados estudos limitados sobre a prevalência dessas doenças em crianças e adolescentes, em razão da dificuldade prática no diagnóstico da esteatose, que é definido por meio de biópsia invasiva e exames como a RM, dispendiosos e que não são realizados de rotina na prática clínica(35). O estudo de Soder et al. avaliou um novo método para tentar quantificar a DHGNA: o US com análise computadorizada usando um software (Image J), que pode quantificar as imagens digitais obtidas pelos aparelhos de US, e dessa forma, a ecogenicidade do parênquima hepático e renal pode ser medida para o cálculo do gradiente. Esses autores analisaram crianças obesas e eutróficas e encontraram diferenças significativas nas medianas do GHRU entre os dois grupos; no entanto, este método diagnóstico não foi comparado com nenhum outro método de imagem(24). De fato, no nosso estudo, o cálculo do GHRU revelou diferença significativa entre as medianas dos adolescentes obesos e dos eutróficos (19,3 versus 10,0; p < 0,001), semelhante ao estudo de Soder et al. (33,9 ± 6,6 versus 14,1 ± 6). Observou-se diferença significativa entre as medianas dos adolescentes com e sem esteatose (22 versus 9; p < 0,001). No entanto, ao se dividir os adolescentes entre com e sem esteatose e reavaliar a diferença entre obesos e eutróficos, não foi identificada diferença significativa entre eles (com esteatose: p = 0,818; sem esteatose: p = 0,971). O cálculo da curva ROC gerada para o GHRU definiu um ponto de corte de 13, com sensibilidade de 100% e especificidade de 100% para predizer esteatose. Considerando esse mesmo ponto de corte para os eutróficos, teríamos 9,5% de falso-positivos (especificidade = 90,5%) e 0% de falso-negativos (sensibilidade = 100%). A acurácia do método foi 100%. O presente estudo foi similar ao desenvolvido por Marshall et al., que definiu ponto de corte maior que 12,7 para esteatose, usando o Image J, com 100% de sensibilidade. Marshall et al. validaram o índice hepatorrenal para o US na DHGNA, comparando com a biópsia hepática(36). Webb et al. conduziram um estudo em pacientes com doença hepática crônica com base na biópsia hepática, obtendo ponto de corte para predizer esteatose maior que 5% de 14,9, com sensibilidade de 100% e especificidade de 91%; o ponto de corte para predizer esteatose igual ou maior que 25% foi 18,6, com sensibilidade de 90% e especificidade de 90%. O ponto de corte ótimo para o índice hepatorrenal para predizer esteatose igual ou maior que 60% foi 22,3, com sensibilidade de 90% e especificidade de 93%, também similar ao encontrado no nosso estudo(37). Em estudo realizado por Saadeh et al., utilizando US convencional, subjetivo, foi demonstrada alta sensibilidade para detecção de esteatose grave (> 33%), mas um valor preditivo positivo de 62% e uma avaliação fraca interobservador para esteatose leve a moderada(38). Já nas pesquisas conduzidas por Strauss et al. observou-se baixa concordância interobservador (kappa = 0,43) e intraobservador (kappa = 0,54) com o US convencional(39). Fishbein et al. constataram excelente correlação na quantificação de gordura hepática por meio da biópsia hepática (pontuação para esteatose) e RM, em adultos com predominante esteatose macrovesicular, associada com DHGNA(23). Em estudo de Pacifico et al., a RM e o US se correlacionaram bem com o conteúdo de gordura microscópica; no entanto, embora a esteatose grave fosse evidente no US em todos os casos, este método não conseguiu ainda delinear o conteúdo de gordura hepática. Apesar de o US e a estimativa de esteatose pela RM se correlacionarem positivamente, as limitações do US em relação à graduação de esteatose foram também observadas, em comparação com a avaliação quantitativa da FG pela RM(28). Além disso, o escore de gordura entre o US e a RM variou. Em crianças nas quais o US revelava moderada a grave esteatose, a RM delineava vasta gama do conteúdo de gordura hepática dentro de ambas as categorias. Isto significa que a utilidade do US parece ser limitada pela sua incapacidade para identificar regressão de gordura ou progressão, respectivamente, em indivíduos com DHGNA. Assim, se uma criança com DHGNA sofrer uma redução de FG à RM de 40% a 20%, mediante intervenção bem-sucedida, seria improvável ter uma correspondente alteração no US(28). No presente estudo, em razão do pequeno número de pacientes com DHGNA (25 adolescentes), diagnosticados pela RM, não foi possível graduar a DHGNA em leve, moderada ou grave com o cálculo do GHRU. Acreditamos que em estudos futuros, com amostragens maiores de pacientes, poderemos, com o cálculo do GHRU, vir a graduar a DHGNA em leve, moderada e grave, por meio do US, como temos feito com a RM, pelo cálculo da FG. Constatamos que as medidas isoladas da ecogenicidade do fígado (p = 0,534) e da ecogenicidade do córtex renal (p = 0,466) não foram significativas entre os obesos e os eutróficos. Contudo, quando o GHRU foi calculado (diferença entre a ecogenicidade do fígado e a ecogenicidade do córtex renal), uma diferença significativa foi detectada entre os grupos de obesos e de eutróficos (19,3 versus 10,0; p < 0,001). Isto pode ser explicado pelo fato de que há pouco ou nenhum efeito da obesidade no córtex renal, que, ao contrário do fígado, é infiltrado por gordura, o que torna o córtex renal um constante parâmetro para o cálculo do GHRU. Um fator limitante deste estudo foi o pequeno número de pacientes obesos e eutróficos na análise, e por isso a não inclusão no estudo de pacientes com sobrepeso. Outro problema é que se estudarmos um parênquima renal alterado, associado com uma doença renal parenquimatosa pré-existente, a doença renal poderá afetar a avaliação do US e o cálculo do GHRU, em comparação com o fígado. Da mesma forma, a presença de fibrose hepática em alguns pacientes poderá tornar a correlação linear entre a infiltração gordurosa e a ecogenicidade renal não confiável. O cálculo do GHRU, no diagnóstico da DHGNA, apresentou alta acurácia nos grupos de adolescentes estudados, sugerindo que este método possa reduzir a alta variabilidade interobservador e intraobservador. Um estudo com a mesma proposta, que avaliou a importância da mensuração da ecogenicidade hepática e renal, foi conduzido por Jeong et al., em 54 pacientes investigados com esteatose classificada como leve, moderada e grave e em pacientes sem esteatose; no entanto, esses autores usaram um histograma em escala de cinza, com parâmetros complexos e cálculos de difícil aplicabilidade na prática clínica diária, mas com resultados bons de sensibilidade e especificidade, quando comparados os escores para esteatose(40) . CONCLUSÃO Sendo o US com análise computadorizada com o Image J e o cálculo do GHRU uma técnica simples e não invasiva para avaliação quantitativa da ecogenicidade hepática, este método poderá vir a ser de ajuda no acompanhamento dos adolescentes obesos e eutróficos, com DHGNA, com reduzido tempo na realização do exame, sem exposição à radiação ionizante como na TC, e com custos reduzidos para a saúde pública. Este método também poderá servir para o rastreamento populacional da DHGNA e para estudos clínicos. REFERÊNCIAS 1. Wieckowska A, McCullough AJ, Feldstein AE. Noninvasive diagnosis and monitoring of nonalcoholic steatohepatitis: present and future. Hepatology. 2007;46:582-9. 2. Pacifico L, Poggiogalle E, Cantisani V, et al. Pediatric nonalcoholic fatty liver disease: a clinical and laboratory challenge. World J Hepatol. 2010;2:275-88. 3. Dunn W, Schwimmer JB. The obesity epidemic and nonalcoholic fatty liver disease in children. Curr Gastroenterol Rep. 2008;10:67-72. 4. Torres DM, Harrison SA. Hepatic progenitor cells: another piece in the nonalcoholic fatty liver disease puzzle. Hepatology. 2012;56:2013-5. 5. Schwimmer JB, Deutsch R, Kahen T, et al. Prevalence of fatty liver in children and adolescents. Pediatrics. 2006;118:1388-93. 6. Nascimento JHR, Epifanio M, Soder RB, et al. MRI-diagnosed nonalcoholic fatty liver disease is correlated to insulin resistance in adolescents. Acad Radiol. 2013;20:1436-42. 7. Ekstedt M, Franzén LE, Mathiesen UL, et al. Long-term follow-up of patients with NAFLD and elevated liver enzymes. Hepatology. 2006;44:865-73. 8. Angulo P, Hui JM, Marchesini G, et al. The NAFLD fibrosis score: a noninvasive system that identifies liver fibrosis in patients with NAFLD. Hepatology. 2007;45:846-54. 9. McGlynn KA, London WT. The global epidemiology of hepatocellular carcinoma: present and future. Clin Liver Dis. 2011;15:223-43, vii-x. 10. Lobstein T, Baur L, Uauy R; IASO International Obesity TaskForce. Obesity in children and young people: a crisis in public health. Obes Rev. 2004;5 Suppl 1:4-104. 11. Franzese A, Vajro P, Argenziano A, et al. Liver involvement in obese children. Ultrasonography and liver enzyme levels at diagnosis and during follow-up in an Italian population. Dig Dis Sci. 1997;42:1428-32. 12. Chan DF, Li AM, Chu WC, et al. Hepatic steatosis in obese Chinese children. Int J Obes Relat Metab Disord. 2004;28:1257-63. 13. Schwimmer JB, McGreal N, Deutsch R, et al Influence of gender, race, and ethnicity on suspected fatty liver in obese adolescents. Pediatrics. 2005;115:e561-5. 14. Adams LA, Lymp JF, St Sauver J, et al. The natural history of nonalcoholic fatty liver disease: a population-based cohort study. Gastroenterology. 2005;129:113-21. 15. Browning JD, Szczepaniak LS, Dobbins R, et al. Prevalence of hepatic steatosis in an urban population in the United States: impact of ethnicity. Hepatology. 2004;40:1387-95. 16. Angulo P. Obesity and nonalcoholic fatty liver disease. Nutr Rev. 2007;65(6 Pt 2):S57-63. 17. Molleston JP. The histopathology of pediatric nonalcoholic fatty liver disease. Hepatology. 2005;42:536-8. 18. Brunt EM. Pathology of nonalcoholic steatohepatitis. Hepatol Res. 2005;33:68-71. 19. Cassidy FH, Yokoo T, Aganovic L, et al. Fatty liver disease: MR imaging techniques for the detection and quantification of liver steatosis. Radiographics. 2009;29:231-60. 20. Schwenzer NF, Springer F, Schraml C, et al. Non-invasive assessment and quantification of liver steatosis by ultrasound, computed tomography and magnetic resonance. J Hepatol. 2009;51:433-45. 21. Bohte AE, van Werven JR, Bipat S, et al. The diagnostic accuracy of US, CT, MRI and 1H-MRS for the evaluation of hepatic steatosis compared with liver biopsy: a meta-analysis. Eur Radiol. 2011;21:87-97. 22. McPherson S, Jonsson JR, Cowin GJ, et al. Magnetic resonance imaging and spectroscopy accurately estimate the severity of steatosis provided the stage of fibrosis is considered. J Hepatol. 2009;51:389-97. 23. Fishbein MH, Gardner KG, Potter CJ, et al. Introduction of fast MR imaging in the assessment of hepatic steatosis. Magn Reson Imaging. 1997;15:287-93. 24. Soder RB, Baldisserotto M, Duval da Silva V. Computer-assisted ultrasound analysis of liver echogenicity in obese and normal-weight children. AJR Am J Roentgenol. 2009;192:W201-5. 25. Pacifico L, Martino MD, Catalano C, et al. T1-weighted dual-echo MRI for fat quantification in pediatric nonalcoholic fatty liver disease. World J Gastroenterol. 2011;17:3012-9. 26. Westphalen AC, Qayyum A, Yeh BM, et al. Liver fat: effect of hepatic iron deposition on evaluation with opposed-phase MR imaging. Radiology. 2007;242:450-5. 27. Qayyum A, Goh JS, Kakar S, et al. Accuracy of liver fat quantification at MR imaging: comparison of out-of-phase gradient-echo and fat-saturated fast spin-echo techniques - initial experience. Radiology. 2005;237:507-11. 28. Pacifico L, Celestre M, Anania C, et al. MRI and ultrasound for hepatic fat quantification:relationships to clinical and metabolic characteristics of pediatric nonalcoholic fatty liver disease. Acta Paediatr. 2007;96:542-7. 29. Souza LRMF, Rodrigues FB, Tostes LV, et al. Imaging evaluation of congenital cystic lesions of the biliary tract. Radiol Bras. 2012;45:113-7. 30. Monjardim RF, Costa DM, Tavares RF, et al. Diagnosis of hepatic steatosis by contrast-enhanced abdominal computed tomography. Radiol Bras. 2013;46:134-8. 31. Eifler RV. The role of ultrasonography in the measurement of subcutaneous and visceral fat and its correlation with hepatic steatosis. Radiol Bras. 2013;46:273-8. 32. Hollanda ES, Torres US, Gual F, et al. Spontaneous perforation of gallbladder with intrahepatic biloma formation: sonographic signs and correlation with computed tomography. Radiol Bras. 2013;46:320-2. 33. Torres LR, Timbó LS, Ribeiro CMF, et al. Multifocal and metastatic hepatic hemangioendothelioma: case report and literature review. Radiol Bras. 2014;47:194-6. 34. Guimarães Filho A, Carneiro Neto LA, Palheta MS, et al. Caroli's disease complicated with liver abscess: case report. Radiol Bras. 2012;45:362-4. 35. Devadason CA, Scheimann AO. Overview of screening methods for fatty liver disease in children. World J Hepatol. 2012;4:1-4. 36. Marshall RH, Eissa M, Bluth EI, et al. Hepatorenal index as an accurate, simple, and effective tool in screening for steatosis. AJR Am J Roentgenol. 2012;199:997-1002. 37. Webb M, Yeshua H, Selber-Sagi S, et al. Diagnostic value of a computerized hepatorenal index for sonographic quantification of liver steatosis. AJR Am J Roentgenol. 2009;192:909-14. 38. Saadeh S, Younossi ZM, Remer EM, et al. The utility of radiological imaging in nonalcoholic fatty liver disease. Gastroenterology. 2002;123:745-50. 39. Strauss S, Gavish E, Gottlieb P, et al. Interobserver and intraobserver variability in the sonographic assessment of fatty liver. AJR Am J Roentgenol. 2007;189:W320-3. 40. Jeong JW, Lee S, Won Lee J, et al. Computer-assisted sonographic analysis of the hepatorenal and textural features for the diagnosis of the fatty liver. Conf Proc IEEE Eng Med Biol Soc. 2005;3:3348-50. 1. Doutor, Médico Radiologista e Professor no Instituto Cenecista de Ensino Superior de Santo Ângelo (IESA), Santo Ângelo, RS, Brasil 2. Doutor, Neurorradiologista do Instituto do Cérebro da Pontifícia Universidade Católica do Rio Grande do Sul (InsCer-PUCRS), Porto Alegre, RS, Brasil 3. Doutor, Coordenador do Internato em Pediatria da Pontifícia Universidade Católica do Rio Grande do Sul (PUCRS), Porto Alegre, RS, Brasil 4. Doutor, Coordenador do Centro de Imagem do Instituto do Cérebro da Pontifícia Universidade Católica do Rio Grande do Sul (InsCer-PUCRS), Porto Alegre, RS, Brasil Endereço para correspondência: Dr. José Hermes Ribas do Nascimento Rua Marechal Floriano, 774, Centro Santo Ângelo, RS, Brasil, 98801-650 E-mail: josehermesnascimento@gmail.com Recebido para publicação em 28/7/2014. Aceito, após revisão, em 5/12/2014. Trabalho realizado na Pontifícia Universidade Católica do Rio Grande do Sul (PUCRS), Porto Alegre, RS, Brasil. |
|
Av. Paulista, 37 - 7° andar - Conj. 71 - CEP 01311-902 - São Paulo - SP - Brazil - Phone: (11) 3372-4544 - Fax: (11) 3372-4554