Radiologia Brasileira - Publicação Científica Oficial do Colégio Brasileiro de Radiologia
AMB - Associação Médica Brasileira CNA - Comissão Nacional de Acreditação
 Vol. 51 nº 3 - Maio / Jun. of 2018
Vol. 51 nº 3 - Maio / Jun. of 2018
|
ARTIGO DE REVISÃO
|
|
|
|
|
Autho(rs): Julia Noschang1; Marcos Duarte Guimarães2; Diogo Fábio Dias Teixeira3; Juliana Cristina Duarte Braga3; Bruno Hochhegger4; Pablo Rydz Pinheiro Santana5; Edson Marchiori6 |
|
|
Descritores: Embolia pulmonar; Tomografia computadorizada de emissão/métodos; Tomografia computadorizada por raios X/métodos; Tomografia computadorizada com dupla energia; Relação ventilação-perfusão. |
|
|
Resumo: INTRODUÇÃO
Tromboembolismo pulmonar (TEP) é uma entidade clínica comum que resulta em morbimortalidade de grande número de pacientes. O TEP é a terceira causa de morte cardiovascular nos Estados Unidos(1), com taxa de incidência de 0,5 a 1 para cada 1000 pessoas/ano(2). No Brasil, estudos sobre a epidemiologia do TEP são raros, analisam dados de autópsias e mostram que, nessas condições, sua prevalência varia de 3,9% a 16,6%(3,4). Dessa forma, embora ocorra com frequência, o diagnóstico continua sendo um grande desafio clínico, pois apresenta sinais e sintomas que estão presentes em grande número de doenças, além de estar associado a fatores de risco também inespecíficos. As bases para o diagnóstico de TEP são a probabilidade clínica pré-teste, o uso do D-dímero e os métodos de imagem(1). Os métodos de imagem atualmente disponíveis para o diagnóstico são a radiografia simples de tórax, a angiografia pulmonar, a cintilografia ventilação-perfusão pulmonar, a ressonância magnética (RM) de tórax, a tomografia computadorizada (TC) de tórax(5) e, mais recentemente, a TC com dupla energia (TCDE)(6). O conceito de TCDE originou-se em 1970, porém, seu uso clínico foi implementado mais recentemente, quando os avanços na tecnologia dos scanners TC, incluindo configurações tanto de dupla-fonte como de fonte única, tornaram viável o uso na prática clínica(7). Na imagem do tórax, a TCDE vem sendo empregada clinicamente para avaliação de enfisema pulmonar, de nódulos pulmonares, de opacidades em vidro fosco, no câncer de pulmão e no diagnóstico de TEP agudo, TEP crônico e hipertensão pulmonar tromboembólica(8). No presente artigo de revisão, os autores analisam a importância do diagnóstico de TEP, bem como os métodos de imagem disponíveis, com ênfase na TCDE. A AVALIAÇÃO DO PACIENTE COM TEP A avaliação diagnóstica do paciente com suspeita de TEP tem início com a análise da probabilidade pré-teste e associação com medida do D-dímero, e quando essa avaliação é indicada, baseia-se, principalmente, em um dos dois critérios mais bem validados: o escore de Wells e a pontuação de Genebra(9,10) (Tabelas 1 e 2). A presença de fatores de risco é uma condição essencial para a suspeita clínica, e os principais fatores são: trauma não cirúrgico e cirúrgico; idade maior que 40 anos; tromboembolismo venoso prévio; imobilização; doença maligna; insuficiência cardíaca; infarto do miocárdio; paralisia de membros inferiores; obesidade; veias varicosas; estrogênio elevado; parto; doença pulmonar obstrutiva crônica(11). 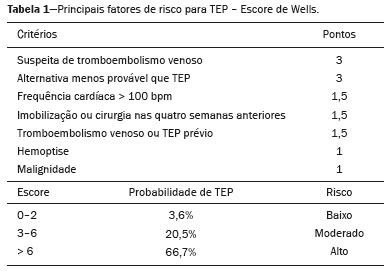 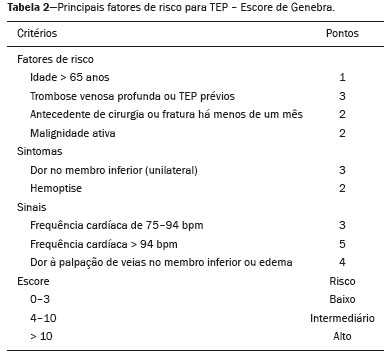 Outra situação que merece destaque é o diagnóstico de TEP de maneira incidental. Na população em geral, TEP é detectado incidentalmente com uma prevalência de 1,0% a 1,5% em exames de imagem realizados para outra finalidade(12). Acredita-se que o TEP incidental pode não ser diagnosticado em função do envolvimento de artéria de pequeno calibre, bem como por possíveis manifestações torácicas de uma doença de base, as quais podem confundir o médico radiologista na avaliação completa das artérias pulmonares(13). AVALIAÇÃO POR IMAGEM DO PACIENTE COM SUSPEITA DE TEP Radiografia simples de tórax A radiografia simples de tórax de paciente com TEP pode apresentar sinais inespecíficos. Em 1940, Hampton et al.(14) descreveram a aparência radiográfica clássica do infarto pulmonar, que se tornou conhecida como corcova de Hampton, uma consolidação periférica em formato de cunha com sua base voltada para a superfície pleural. Posteriormente, diversos padrões de imagem foram associados ao infarto pulmonar e incluem: consolidação periférica sem broncograma aéreo, escavação asséptica e consolidação contendo áreas radiolucentes (distintas do broncograma aéreo). Além disso, outros sinais foram relatados como associados ao TEP, destacando-se o sinal de Westermark (oligoemia na região do pulmão irrigada pelo vaso ocluído), elevação da hemicúpula diafragmática ipsilateral, alargamento proximal da artéria pulmonar, atelectasias e derrame pleural(1). As anormalidades mais comuns são atelectasias, pequenos derrames pleurais e redução localizada do fluxo sanguíneo periférico, com ou sem distensão dos vasos proximais. As atelectasias resultam na perda de volume em zonas mais baixas, causada pela isquemia, a qual induz à deficiência de surfactante(15). Apesar de as radiografias simples de tórax estarem anormais na maioria dos casos de TEP, em 40% elas podem estar normais(16). Angiografia pulmonar Angiografia pulmonar é um método diagnóstico invasivo, no qual se introduz um cateter por via intravenosa na artéria pulmonar proximal e o meio de contraste é injetado rapidamente. A técnica oferece elevada resolução espacial, permitindo avaliar diretamente o sistema arterial pulmonar. Os achados de defeito de enchimento da coluna de contraste são típicos de TEP (Figura 1). 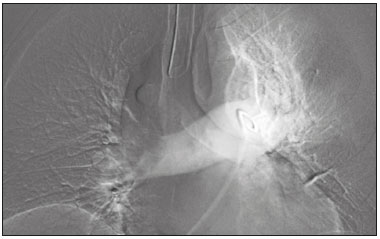 Figura 1. Arteriografia pulmonar identificando falha de enchimento no tronco da pulmonar bilateralmente, com preservação da opacificação pelo meio de contraste apenas no segmento apicoposterior. Embora seja considerada como padrão ouro, o método pode implicar complicações, sendo as principais: anafilaxia, nefrotoxicidade induzida de contraste e complicações cardíacas e pulmonares(11). A angiografia pulmonar apresenta taxa de complicações fatais de 0,5%, de complicações maiores não fatais (ameaça à vida, sem resposta à terapia ou necessidade de tratamento intensivo ou prolongado no hospital) de 1% e de complicações menores (acompanhamento prolongado de uma complicação que regrediu espontaneamente sem danos residuais) de 5%(17). Cintilografia ventilação-perfusão pulmonar A cintilografia ventilação-perfusão pulmonar baseia- se na presença de ventilação em regiões sem perfusão, em localização distal a êmbolos obstrutivos, sugerindo o diagnóstico de TEP (Figura 2). Os achados cintilográficos são classificados em termos de probabilidade para a presença de embolismo em: alta probabilidade, probabilidade intermediária, baixa probabilidade, quase normal ou muito baixa probabilidade e normal. Os exames de cintilografia de alta probabilidade confirmam o diagnóstico de TEP, enquanto os exames de muito baixa probabilidade e os normais permitem excluir o diagnóstico. Porém, a limitação da cintilografia ventilação-perfusão está relacionada a elevado número de pacientes em que os achados não são conclusivos. 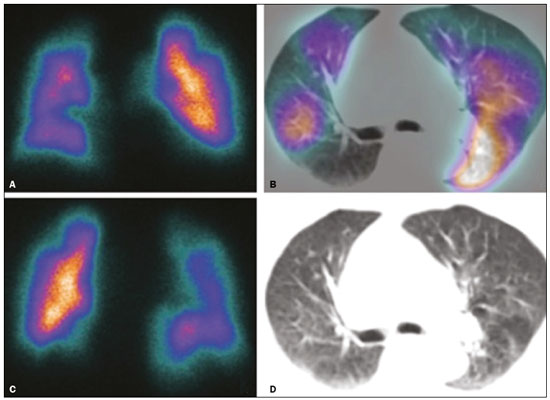 Figura 2. Cintilografia de perfusão pulmonar em cortes coronais (A,B) e SPECT/TC em cortes axiais (C,D) em paciente do sexo masculino, 77 anos, demonstrando múltiplos defeitos de perfusão em forma de cunha, bilateralmente, sem alterações parenquimatosas, indicando alta probabilidade para TEP. De acordo com o estudo Prospective Investigation of Pulmonary Embolism Diagnosis (PIOPED), em dois terços dos pacientes que realizaram cintilografia ventilação- perfusão o método foi incapaz de estabelecer ou excluir o diagnóstico de TEP(18). Além disso, pode-se associar aos dados funcionais da cintilografia os dados anatômicos da TC com emissão de fóton único (SPECT)/TC. Existem poucos estudos sobre a utilidade da SPECT/TC no diagnóstico do TEP, e não há recomendações definidas em relação ao método. Entretanto, acredita-se que a SPECT/TC possui alta acurácia no diagnóstico (99%), com sensibilidade de 97% a 100% e especificidade de 83% a 100%(19,20). RM de tórax O desenvolvimento de novas técnicas em RM, as quais reduzem o tempo de aquisição, aumentam a resolução e diminuem os artefatos de movimento, tem permitido o uso desse método para o diagnóstico de TEP. A sensibilidade e a especificidade da RM para avaliação de TEP variam de 78% a 100% e 95% a 100%, respectivamente(21,22). O estudo PIOPED III avaliou a acurácia da RM com gadolínio, e quando a técnica foi adequada, a RM apresentou sensibilidade de 78% e especificidade de 99%. Porém, a média de exames considerados tecnicamente inadequados foi 25%. Assim, incluindo pacientes com imagens tecnicamente inadequadas, houve redução de 57% da sensibilidade(23). A concordância entre tomografia computadorizada com múltiplos detectores e RM é maior quando as técnicas de RM são analisadas de maneira conjunta (RM tempo real, angiografia por RM e cintilografia de perfusão por RM), com sensibilidade de 100% e especificidade de 93%(24). Dessa forma, a RM, por apresentar alta sensibilidade e especificidade, é uma alternativa não ionizante eficaz para o diagnóstico de TEP (Figura 3). 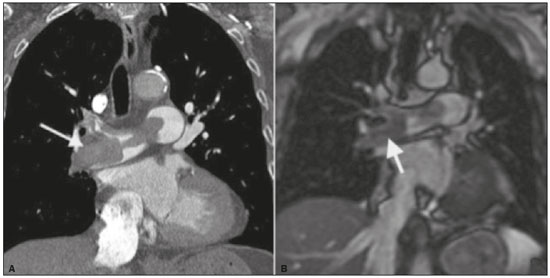 Figura 3. Correlação de TC em corte coronal (A) e RM com sequência coronal fast-spin-eco ponderada em T2 (B) demonstrando falha de enchimento na bifurcação das artérias pulmonares. TC de tórax A TC de tórax tem sido motivo de uma série de publicações radiológicas na literatura brasileira(25–31). Ela é cada vez mais utilizada para o diagnóstico de TEP, sendo considerada o método padrão para esse diagnóstico em muitas instituições(32). Entretanto, o diagnóstico de pequenos êmbolos periféricos constitui uma limitação do método, havendo perda de 53% dos casos de TEP periféricos ou subsegmentares(33). A TC de tórax com finalidade de diagnóstico de TEP é realizada com o uso de contraste iodado intravenoso. Para o acesso intravenoso, utiliza-se cateter com calibre de 18 ou 20 e uma veia antecubital como acesso preferencial. O volume de contraste injetado é de 135 mL, com taxa de infusão de 4 mL/s. As imagens são exibidas em três escalas de cinza diferentes, ou seja, janela de pulmão (largura da janela/nível de unidades Hounsfield [UH] = 1500/600), janela de mediastino (400/40) e específica para embolia pulmonar (700/100)(34). O diagnóstico por meio da TC se baseia na identificação de falhas de enchimento intraluminal pelo contraste. Os critérios diagnósticos para embolia pulmonar aguda incluem: oclusão arterial com falha de enchimento de todo o lúmen, estando a artéria ocluída com diâmetro aumentado em comparação aos vasos adjacentes; defeito de enchimento parcial pelo meio de contraste produzindo o sinal do polo mint em imagens perpendiculares ao eixo longo do vaso e sinal do "trilho de trem" em imagens adquiridas no eixo longo do vaso; e defeitos de enchimento periféricos formando ângulos agudos com a parede arterial (Figura 4). Os critérios diagnósticos para TEP crônico incluem: completa oclusão de um vaso associada a um menor calibre do vaso ocluído em relação ao adjacente; defeito de enchimento periférico em forma de crescente formando ângulo obtuso com a parede arterial; contraste fluindo de maneira grosseira, comumente associado a recanalização arterial; e presença de uma "teia" no interior de uma artéria preenchida por contraste(34) (Figura 5). 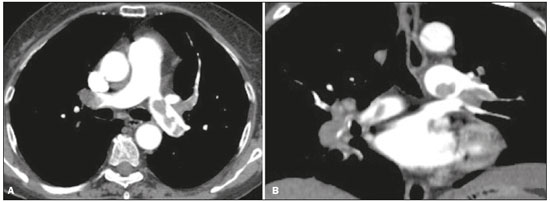 Figura 4. TEP agudo em paciente do sexo feminino, 62 anos. TC em cortes axial (A) e coronal (B) mostrando extensa falha de enchimento irregular nas artérias pulmonares direita e esquerda, com extensão para seus ramos segmentares. 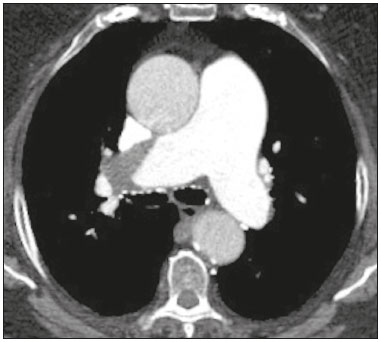 Figura 5. TEP crônico em paciente do sexo feminino, 86 anos, com antecedente de câncer de mama. TC axial demonstrando falha de enchimento com margens obtusas na artéria pulmonar direita, com patência de fluxo no leito distal. TCDE Princípios básicos da TCDE A TCDE utiliza como princípio a tese de que os materiais se comportam de maneira distinta quando são expostos a fótons de raios X com diferentes energias. Assim, permite distinguir materiais com composição molecular diferentes baseando-se na atenuação(35,36). O desenvolvimento da TCDE se tornou possível mediante modificações em tomógrafos convencionais de várias maneiras, resultando em diferentes sistemas de TCDE. Os primeiros foram scanners TC de energia simples baseados na aquisição de dois conjuntos sequenciais de imagens com diferentes espectros de fótons (por exemplo, 80 kVp seguido de 140 kVp). Destaca-se como limitação da dupla energia sequencial a alteração do reforço pós-material de contraste ao longo do tempo, prejudicando a mensuração da decomposição da matéria. A aquisição das imagens com duas energias simultâneas soluciona essa limitação, e algoritmos pós-processamento permitem que os materiais sejam diferenciados. Atualmente, duas técnicas de TCDE estão aprovadas pela Food and Drug Administration, dos Estados Unidos, para uso clínico: os scanners TC dupla fonte e a TC de fonte única com comutação rápida do tubo tensão(35,37). O avanço no uso clínico da TCDE foi acompanhado da preocupação com relação à quantidade de radiação implicada no uso dessa técnica. Múltiplos estudos compararam o uso da TC convencional com a TCDE e concluíram que nenhum dos dois métodos representa maior ou menor exposição à radiação, quando comparados entre si. A maioria dos estudos não deu atenção à normalização da qualidade da imagem, à relação sinal-ruído ou ao produto dose-comprimento(38). Entretanto, acredita-se que a TCDE é viável sem dose adicional, não havendo diferença significativa no ruído da imagem, uma vez que a relação ruído/contraste pode ser potencializada otimizando-se as reconstruções da TCDE(32). Destaca-se, ainda, que os estudos avaliando TC de fonte única com comutação rápida do tubo tensão são inconclusivos(38). Técnicas de pós-processamento São utilizadas duas abordagens para obter as informações pós-processamento. Uma delas baseia-se em subtrair projeções equivalentes e aplicar filtro em projeções anteriores para reconstruir as diferenças nas informações espectrais. Outra maneira é, em primeiro lugar, reconstruir imagens padrão TC em voxels em UH. Em seguida, deve-se usar algoritmos de pós-processamento para extrair informações espectrais específicas a partir da diferença entre os voxels correspondentes. Atualmente, a abordagem mais comumente usada é a latter, com um sistema de reconstrução de imagem caracterizada por possuir baixa e alta quilovoltagem e uma série de reproduções com a média ponderada(37). As técnicas de reconstrução da imagem pós-processamento utilizadas na TCDE são principalmente o mapa de atenuação do iodo, imagens sem contraste virtuais e imagens monocromáticas virtuais(35,36). Para o diagnóstico do TEP é utilizado mapeamento com iodo, que permite a visualização da distribuição e a quantidade da substância no parênquima pulmonar, o qual possui relação com a perfusão pulmonar. A TCDE dupla fonte usa um algoritmo de decomposição de três materiais, com propriedades de absorção de raios X conhecidas (iodo, tecidos moles e gordura) em baixa e alta energia. A quantidade estimada de cada material é calculada com base no seu perfil de atenuação em diferentes níveis de energia; assim, gera-se um mapa iodo-específico determinando a quantidade de iodo no tecido em UH. A TCDE fonte única usa um algoritmo de dois materiais de decomposição no espaço de projeção. As medidas de atenuação dos materiais selecionados (ou seja, água e iodo) com altas e baixas energias são matematicamente transformadas para calcular os valores que seriam necessários para determinar esses níveis de atenuação(35). As imagens para avaliação do iodo podem ser exibidas de maneira quantitativa como uma imagem em escala de cinza, ou de maneira qualitativa na forma de um mapa colorido. Ambas as formas fornecem uma avaliação indireta sobre o ambiente microvascular do tecido subjacente. Na TCDE dupla fonte, o iodo quantificado é expresso em UH e o valor médio representa o reforço, e na de fonte única, a quantidade de iodo no tecido é expressa em miligramas por mililitro. Outra forma de avaliar a perfusão pulmonar por meio da TC consiste na técnica de subtração de uma fase pós-contraste de uma pré-contraste, criando-se mapas de iodo semelhantes aos fornecidos pela TCDE(39). Diagnóstico de TEP pela TCDE A TCDE acrescenta, à informação morfológica fornecida pela TC, dados com relação à perfusão do parênquima pulmonar, por meio do mapeamento com iodo, o qual permite a visualização da distribuição do iodo no parênquima(36) (Figura 6). Com o uso do mapa de iodo na TCDE espera-se que melhore a acurácia no diagnóstico de TEP, principalmente para TEP segmentar e subsegmentar (Figura 7), isto porque, na prática clinicorradiológica, pequenos trombos segmentares e subsegmentares podem não ser detectados pela TC. 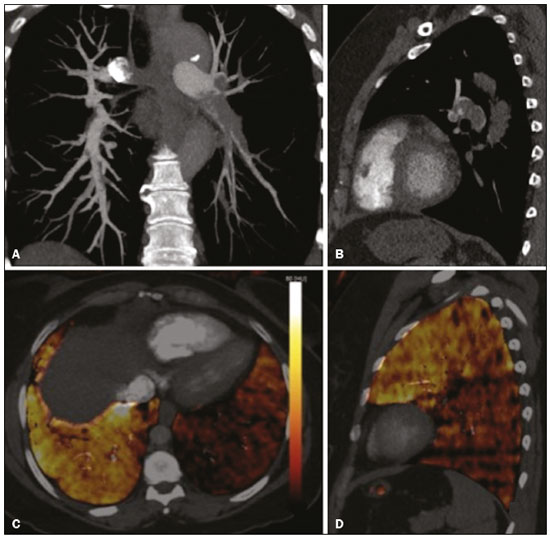 Figura 6. TC em cortes coronal (A) e sagital (B) demonstrando extensas falhas de enchimento acometendo ramos arteriais pulmonares, principalmente para o lobo inferior esquerdo. TC de dupla energia em cortes axial (C) e sagital (D) mostrando extenso defeito perfusional no lobo inferior esquerdo decorrente de TEP agudo. 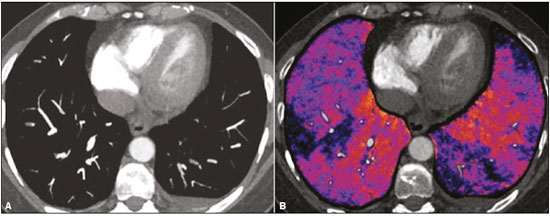 Figura 7. TC em corte axial (A) e mapa de iodo realizado pela técnica de subtração (B) identificando falhas de enchimento em ramos subsegmentares bilateralmente, em correlação com os defeitos perfusionais associados. Estudos avaliando o uso da TCDE vêm demonstrando melhora na detecção de TEP quando essa técnica é utilizada, comparando-a com o uso da TC convencional. Análise realizada em estudo experimental demonstrou maior sensibilidade na detecção do TEP com o uso da TCDE (67% na TC convencional versus 89% na TCDE)(40). Em concordância com estudo experimental, os estudos clínicos também demonstram benefícios no uso da dupla energia. A sensibilidade e a especificidade para avaliação do TEP por paciente chegaram a 100%(41), com sensibilidade variando de 84,6% a 100% e especificidade variando de 93,3% a 100%. Já a avaliação com base no segmento pulmonar apresenta sensibilidade de 60% a 82,9% e especificidade de 99,5% a 99,8%(41,42). Deve-se ressaltar importantes característica da TCDE, que são as altas taxas de concordância interobservador e intraobservador, demonstrando boa aplicabilidade do método na prática clínica(43). No entanto, os contatos dos segmentos pulmonares com o mediastino superior e com as câmaras cardíacas foram considerados fatores limitantes para adequada avaliação do TEP na TCDE(44). Os achados de defeitos perfusionais demonstrados pela TCDE possuem boa concordância com os achados da cintilografia ventilação-perfusão. Em estudo comparando a TCDE com a cintilografia em pacientes que receberam ambas as técnicas, com intervalo médio entre elas de três dias, a acurácia do diagnóstico por paciente mostrou sensibilidade de 75%, especificidade de 80% e valor preditivo negativo de 93%. A sensibilidade avaliada por segmento pulmonar foi 83%, a especificidade, 99%, e o valor preditivo negativo, 93%(45). Outro estudo, comparando a perfusão pulmonar com a TCDE e a SPECT/TC, a TCDE demonstrou sensibilidade/especificidade de 100% para TEP agudo, enquanto a combinação de SPECT/TC e cintilografia de ventilação-perfusão teve sensibilidade de 85,7% e especificidade de 87,5%(46). Apesar do limitado número de estudos comparando a perfusão pulmonar demonstrada pelo mapa de iodo e com a demonstrada pela RM pulmonar, os resultados não são satisfatórios. Até o momento, parece não haver correlação significativa entre os métodos, evidenciando-se apenas um nível moderado de correlação visual(47). Com relação à TCDE, destaca-se a possibilidade de correlação entre a extensão do defeito perfusional e o prognóstico, uma vez que volume de defeito de perfusão significativamente maior (35% ± 11% versus 23% ± 10%; p = 0,002) está associado a desfecho clínico adverso(48). Limitações da TCDE Apesar de a TCDE ser uma ferramenta promissora para o diagnóstico do TEP, há alguns desafios para o uso na prática clínica. Citam-se como fatores que limitam o uso da TCDE: – Relacionados ao scanner: acesso limitado à TCDE, alto custo, tempo de processamento das imagens relativamente longo, o field of view menor do tubo B pode não incluir a porção periférica do tórax e assim a TCDE não pode ser usada para o pós-processamento de dupla energia. – Relacionados ao paciente: a obesidade pode aumentar o ruído da imagem, o que interfere em análise estrutural e funcional. Além disso, frequentemente, o peso do paciente excede o permitido nos aparelhos de TCDE. – Interpretação: número pequeno de médicos radiologistas que possuem conhecimento sobre a técnica. Uma terminologia padrão ainda não foi definida. Artefatos na interpretação da imagem Artefatos nas imagens do mapa de concentração do iodo devem ser considerados, a fim de evitar diagnósticos errados. Eles estão relacionados ao contraste, à distribuição fisiológica do contraste e à doença pulmonar. Regiões com alta concentração do contraste iodado podem provocar efeito de endurecimento de feixe, resultando em locais com defeito na contrastação adjacente a uma área com grande reforço pelo contraste. A ação fisiológica da gravidade também deve ser reconhecida, uma vez que, em exames realizados em decúbito dorsal, as regiões anteriores do tórax costumam apresentar menos realce de contraste. Por outro lado, trombos não oclusivos podem resultar em falso-negativos com pouco defeito de realce na região correspondente. Ainda, a redução dos capilares sanguíneos em pacientes idosos e em regiões com enfisema pode provocar defeitos de realce(49). CONCLUSÃO A TCDE é capaz de identificar defeitos de perfusão com boa acurácia, além de fornecer imagens para avaliação da morfologia do parênquima pulmonar em alta resolução. Dessa forma, esta técnica possui potencial para aumentar a precisão e a segurança no diagnóstico de TEP. REFERÊNCIAS 1. Pipavath SN, Godwin JD. Acute pulmonary thromboembolism: a historical perspective. AJR Am J Roentgenol. 2008;191:639–41. 2. Laack TA, Goyal DG. Pulmonary embolism: an unsuspected killer. Emerg Med Clin North Am. 2004;22:961–83. 3. White RH. The epidemiology of venous thromboembolism. Circulation. 2003;107(23 Suppl 1):I4–8. 4. Anderson FA Jr, Wheeler HB, Goldberg RJ, et al. A population-based perspective of the hospital incidence and case-fatality rates of deep vein thrombosis and pulmonary embolism. The Worcester DVT Study. Arch Intern Med. 1991;151:933–8. 5. van Strijen MJ, de Monyé W, Kieft GJ, et al. Diagnosis of pulmonary embolism with spiral CT as a second procedure following scintigraphy. Eur Radiol. 2003;13:1501–7. 6. Raja AS, Greenberg JO, Qaseem A, et al. Evaluation of patients with suspected acute pulmonary embolism: best practice advice from the Clinical Guidelines Committee of the American College of Physicians. Ann Intern Med. 2015;163:701–11. 7. Kaza RK, Platt JF, Cohan RH, et al. Dual-energy CT with single- and dual-source scanners: current applications in evaluating the genitourinary tract. Radiographics. 2012;32:353–69. 8. Lu GM, Zhao Y, Zhang LJ, et al. Dual-energy CT of the lung. AJR Am J Roentgenol. 2012;199(5 Suppl):S40–53. 9. Wells PS, Anderson DR, Rodger M, et al. Derivation of a simple clinical model to categorize patients probability of pulmonary embolism: increasing the models utility with the SimpliRED D-dimer. Thromb Haemost. 2000;83:416–20. 10. Le Gal G, Righini M, Roy PM, et al. Prediction of pulmonary embolism in the emergency department: the revised Geneva score. Ann Intern Med. 2006;144:165–71. 11. Volschan A, Caramelli B, Gottschall CA, et al. Guidelines for pulmonary embolism. Arq Bras Cardiol. 2004;83 Suppl 1:1–8. 12. Gosselin MV, Rubin GD, Leung AN, et al. Unsuspected pulmonary embolism: prospective detection on routine helical CT scans. Radiology. 1998;208:209–15. 13. Gladish GW, Choe DH, Marom EM, et al. Incidental pulmonary emboli in oncology patients: prevalence, CT evaluation, and natural history. Radiology. 2006;240:246–55. 14. Hampton AO, Castleman B. Correlation of post-mortem chest teleroentgenograms with autopsy findings with special reference to pulmonary embolism and infarction. Am J Roentgenol Radium Ther. 1940;40:305–26. 15. Bergus GR, Barloon TS, Kahn D. An approach to diagnostic imaging of suspected pulmonary embolism. Am Fam Physician. 1996;53: 1259–66. 16. Greenspan RH, Ravin CE, Polansky SM, et al. Accuracy of the chest radiograph in diagnosis of pulmonary embolism. Invest Radiol. 1982;17:539–43. 17. Stein PD, Athanasoulis C, Alavi A, et al. Complications and validity of pulmonary angiography in acute pulmonary embolism. Circulation. 1992;85:462–8. 18. PIOPED Investigators. Value of the ventilation/perfusion scan in acute pulmonary embolism. Results of the prospective investigation of pulmonary embolism diagnosis (PIOPED). JAMA. 1990; 263:2753–9. 19. Gutte H, Mortensen J, Jensen CV, et al. Detection of pulmonary embolism with combined ventilation-perfusion SPECT and low-dose CT: head-to-head comparison with multidetector CT angiography. J Nucl Med. 2009;50:1987–92. 20. Mazurek A, Dziuk M, Witkowska-Patena E, et al. The utility of hybrid SPECT/CT lung perfusion scintigraphy in pulmonary embolism diagnosis. Respiration. 2015;90:393–401. 21. Yue K. Diagnosis efficiency for pulmonary embolism using magnetic resonance imaging method: a meta-analysis. Int J Clin Exp Med. 2015;8:14416–23. 22. Stein PD, Woodard PK, Hull RD, et al. Gadolinium-enhanced magnetic resonance angiography for detection of acute pulmonary embolism: an in-depth review. Chest. 2003;124:2324–8. 23. Stein PD, Chenevert TL, Fowler SE, et al. Gadolinium-enhanced magnetic resonance angiography for pulmonary embolism: a multicenter prospective study (PIOPED III). Ann Intern Med. 2010;152:434–43, W142–3. 24. Kluge A, Luboldt W, Bachmann G. Acute pulmonary embolism to the subsegmental level: diagnostic accuracy of three MRI techniques compared with 16-MDCT. AJR Am J Roentgenol. 2006; 187:W7–14. 25. Barbosa DL, Hochhegger B, Souza Jr AS, et al. High-resolution computed tomography findings in eight patients with hantavirus pulmonary syndrome. Radiol Bras. 2017;50:148–53. 26. Belém LC, Souza CA, Souza Jr AS, et al. Metastatic pulmonary calcification: high-resolution computed tomography findings in 23 cases. Radiol Bras. 2017;50:231–6. 27. Mogami R, Goldenberg T, Marca PGC, et al. Pulmonary infection caused by Mycobacterium kansasii: findings on computed tomography of the chest. Radiol Bras. 2016;49:209–13. 28. Queiroz RM, Gomes MP, Valentin MVN. Pulmonary paracoccidioidomycosis showing reversed halo sign with nodular/coarse contour. Radiol Bras. 2016;49:59–60. 29. Bastos AL, Corrêa RA, Ferreira GA. Tomography patterns of lung disease in systemic sclerosis. Radiol Bras. 2016;49:316–21. 30. Torres PPTS, Moreira MAR, Silva DGST, et al. High-resolution computed tomography and histopathological findings in hypersensitivity pneumonitis: a pictorial essay. Radiol Bras. 2016;49:112–6. 31. Ribeiro BNF, Ribeiro RN, Zanetti G, et al. Hughes-Stovin syndrome: an unusual cause of pulmonary artery aneurysms. Radiol Bras. 2016;49:202–3. 32. Wittram C, Meehan MJ, Halpern EF, et al. Trends in thoracic radiology over a decade at a large academic medical center. J Thorac Imaging. 2004;19:164–70. 33. Winer-Muram HT, Rydberg J, Johnson MS, et al. Suspected acute pulmonary embolism: evaluation with multi-detector row CT versus digital subtraction pulmonary arteriography. Radiology. 2004;233:806–15. 34. Wittram C, Maher MM, Yoo AJ, et al. CT angiography of pulmonary embolism: diagnostic criteria and causes of misdiagnosis. Radiographics. 2004;24:1219–38. 35. Agrawal MD, Pinho DF, Kulkarni NM, et al. Oncologic applications of dual-energy CT in the abdomen. Radiographics. 2014;34:589–612. 36. De Cecco CN, Darnell A, Rengo M, et al. Dual-energy CT: oncologic applications. AJR Am J Roentgenol. 2012;199(5 Suppl):S98–S105. 37. Johnson TR. Dual-energy CT: general principles. AJR Am J Roentgenol. 2012;199(5 Suppl):S3–8. 38. Henzler T, Fink C, Schoenberg SO, et al. Dual-energy CT: radiation dose aspects. AJR Am J Roentgenol. 2012;199(5 Suppl):S16–25. 39. Brink M, Verschoor A, Heijdra Y, et al. Subtraction techniques enable single-energy iodinemapping of pulmonary perfusion: an educational exhibit. European Congress of Radiology 2014; 2014 Mar 6–10; Vienna, Austria. 40. Zhang LJ, Zhao YE, Wu SY, et al. Pulmonary embolism detection with dual-energy CT: experimental study of dual-source CT in rabbits. Radiology. 2009;252:61–70. 41. Fink C, Johnson TR, Michaely HJ, et al. Dual-energy CT angiography of the lung in patients with suspected pulmonary embolism: initial results. Rofo. 2008;180:879–83. 42. Lee CW, Seo JB, Song JW, et al. Evaluation of computer-aided detection and dual energy software in detection of peripheral pulmonary embolism on dual-energy pulmonary CT angiography. Eur Radiol. 2011;21:54–62. 43. Cai XR, Feng YZ, Qiu L, et al. Iodine distribution map in dual-energy computed tomography pulmonary artery imaging with rapid kVp switching for the diagnostic analysis and quantitative evaluation of acute pulmonary embolism. Acad Radiol. 2015;22:743–51. 44. Pontana F, Faivre JB, Remy-Jardin M, et al. Lung perfusion with dual-energy multidetector-row CT (MDCT): feasibility for the evaluation of acute pulmonary embolism in 117 consecutive patients. Acad Radiol. 2008;15:1494–504. 45. Thieme SF, Becker CR, Hacker M, et al. Dual energy CT for the assessment of lung perfusion—correlation to scintigraphy. Eur J Radiol. 2008;68:369–74. 46. Thieme SF, Graute V, Nikolaou K, et al. Dual energy CT lung perfusion imaging—correlation with SPECT/CT. Eur J Radiol. 2012;81:360–5. 47. Hansmann J, Apfaltrer P, Zoellner FG, et al. Correlation analysis of dual-energy CT iodine maps with quantitative pulmonary perfusion MRI. World J Radiol. 2013;5:202–7. 48. Apfaltrer P, Bachmann V, Meyer M, et al. Prognostic value of perfusion defect volume at dual energy CTA in patients with pulmonary embolism: correlation with CTA obstruction scores, CT parameters of right ventricular dysfunction and adverse clinical outcome. Eur J Radiol. 2012;81:3592–7. 49. Lu GM, Wu SY, Yeh BM, et al. Dual-energy computed tomography in pulmonary embolism. Br J Radiol. 2010;83:707–18. 1. Médica Residente de Radiologia do Departamento de Imagem do A.C.Camargo Cancer Center, São Paulo, SP, Brasil 2. Doutor, Médico Titular do Departamento de Imagem do A.C.Camargo Cancer Center, São Paulo, SP, Brasil 3. Graduandos em Medicina da Universidade Anhembi Morumbi (UAM), São Paulo, SP, Brasil 4. Doutor, Professor Adjunto de Radiologia da Universidade Federal de Ciências da Saúde de Porto Alegre (UFCSPA), Porto Alegre, RS, Brasil 5. Médico Radiologista da Med Imagem/Hospital Beneficência Portuguesa e do Grupo Fleury, São Paulo, SP, Brasil 6. Professor Titular de Radiologia da Universidade Federal do Rio de Janeiro (UFRJ), Rio de Janeiro, RJ, Brasil Trabalho realizado no Departamento de Imagem do A.C.Camargo Cancer Center, São Paulo, SP, Brasil. Endereço para correspondência: Diogo Fábio Dias Teixeira Rua Paulo Orozimbo, 726, Cambuci São Paulo, SP, Brasil, 01535-001 E-mail: diogodiast@gmail.com Recebido para publicação em 17/10/2017. Aceito, após revisão, em 16/11/2017. |
|
Av. Paulista, 37 - 7° andar - Conj. 71 - CEP 01311-902 - São Paulo - SP - Brazil - Phone: (11) 3372-4544 - Fax: (11) 3372-4554