Radiologia Brasileira - Publicação Científica Oficial do Colégio Brasileiro de Radiologia
AMB - Associação Médica Brasileira CNA - Comissão Nacional de Acreditação
 Vol. 51 nº 4 - Jul. / Ago. of 2018
Vol. 51 nº 4 - Jul. / Ago. of 2018
|
ARTIGO DE REVISÃO
|
|
|
|
|
Autho(rs): André Vaz1; Cesar Rodrigo Trippia2 |
|
|
Descritores: Osso e ossos; Variação anatômica; Ressonância magnética; Tomografia computadorizada; Radiologia. |
|
|
Resumo: INTRODUÇÃO
Ossículos acessórios são inconstantes, independentes e considerados bem formados, não provenientes de fraturas ou outras doenças, porém, igualmente suscetíveis a ambas essas condições(1). Derivam de núcleos de ossificação acessórios não fusionados(2), os quais podem formar ossículos livres, sesamoides (embebidos em um tendão) ou bipartidos (divisão congênita não traumática)(1). Foram descritos pela primeira vez por Vesalius em 1543(1), porém, o tema atraiu pouca atenção até recentemente, tendo em vista a ausência de conhecimento das suas implicações clínicas antes do advento da radiologia. Atualmente, o interesse nessa área tem aumentado, em razão do relato de síndromes dolorosas relacionadas a esses ossículos(2). O propósito deste trabalho é ressaltar uma série de casos de ossículos acessórios ou bipartidos com importância clínica, por causar sintomas ou por possuir diagnósticos diferenciais importantes, com base no acervo de um dos autores. OS VESALIANUM PEDIS O ossículo acessório presente adjacente à base do 5º metatarso consiste no os vesalianum pedis (Figura 1). Foi descrito por Pfitzner em 1900 como um ossículo que consistiria na tuberosidade do 5º metatarso, entretanto, essa definição é contestada, pois há autores que consideram que o os vesalianum pedis é adjacente a uma tuberosidade normalmente desenvolvida(1,2). A incidência dessa variação anatômica situa-se entre 0,1% e 0,4%(2,3). Na maioria das vezes é considerada um achado incidental assintomático, porém, há relatos de síndromes dolorosas(4). 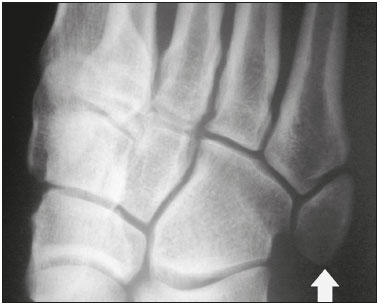 Figura 1. Radiografia do pé esquerdo (detalhe) na incidência oblíqua mostrando um ossículo não fusionado à base do 5º metatarso (seta), com margens corticais bem formadas e aparente articulação com a base do 5º metatarso e cuboide, separada por uma linha radiolucente de espessura constante, caracterizando o os vesalianum pedis. O os vesalianum pedis deve ser distinguido do os peroneum, da apófise do 5º metatarso, da doença de Iselin e de fraturas por avulsão da tuberosidade do 5º metatarso, de Jones ou por estresse. A identificação de uma articulação com o cuboide pode orientar o diagnóstico, pois sugere os vesalianum pedis(5), mas tomografia e/ou ressonância podem ser necessárias para o diagnóstico preciso do achado. O os peroneum é um sesamoide dentro do tendão do músculo fibular longo, adjacente à articulação calcaneocubóidea (mais proximal que o os vesalianum pedis), relativamente frequente, incidente em 9% a 26% dos pés(2,3,6). A apófise do 5º metatarso é paralela ao maior eixo da diáfise do metatarso(2,3) e pode ser identificada radiologicamente dos 9 aos 11 anos até se fusionar ao eixo ósseo em indivíduos entre 12 e 16 anos(3). A doença de Iselin consiste na apofisite autolimitada por tração da base do 5º metatarso, decorrente de microtrauma repetido. A radiografia pode demonstrar aumento ou fragmentação da junção osteocondral e a ressonância pode demonstrar edema ósseo(7). A fratura por avulsão da tuberosidade do 5º metatarso decorre de uma inversão forçada do pé. O aumento da tensão sobre o tendão do músculo fibular curto no movimento causa o destacamento da apófise e o traço da fratura fica transversal na base do 5º metatarso(2). A fratura de Jones foi descrita em 1902 em uma série de seis casos (incluindo o próprio autor) de fratura transversal ao maior eixo do 5º metatarso a aproximadamente 2 cm de sua base, entre as inserções dos tendões dos músculos fibular curto e terceiro(8), todas relacionadas a inversão forçada e flexão plantar do pé(9). A fratura por estresse evolui de microfraturas para fratura completa a, em média, 1,5 cm da diáfise proximal do 5º metatarso(8). A escassa irrigação da região metadiafisária geralmente compromete a cicatrização dessas fraturas, podendo resultar em retardo ou não consolidação dos fragmentos(8). Portanto, a sequela dessas fraturas também pode confundir o diagnóstico com o os vesalianum pedis. ESCAFOIDE BIPARTIDO Os primeiros relatos de divisão do escafoide foram publicados em 1877 e 1895 por Gruber e Pfitzner. Foram dissecadas, respectivamente, 3007 e 1450 peças, porém apenas 4 (0,13%) e 9 (0,62%) casos foram encontrados. Fratura era a principal hipótese da divisão, mas foi proposta uma hipótese de não fusão dos componentes de ossificação radial e ulnar do escafoide, formando um escafoide bipartido(10) (Figura 2). 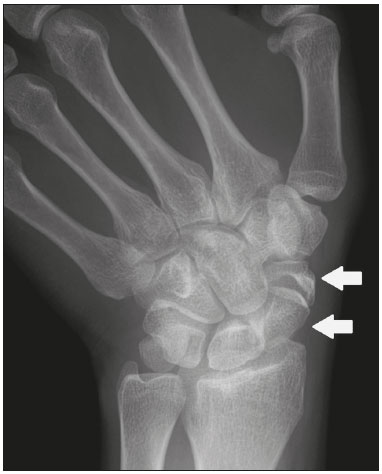 Figura 2. Radiografia de punho direito em desvio ulnar identificando um escafoide dividido (setas) no terço distal, com o fragmento medial maior que o lateral e ambos com margens aparentemente bem formadas e regulares, sugestivo de escafoide bipartido. Dwight, em 1906, relatou um caso de escafoide bipartido ao nascimento e pôde ratificar a hipótese de não fusão(11). Entretanto, essa teoria tem sido questionada. Louis et al. revisaram 17.439 radiografias de punho (5365 eram crianças entre 4,5 e 12,5 anos) e encontraram 3 casos (0,01%) de múltiplos centros de ossificação do escafoide em crianças, porém, nenhum caso de escafoide bipartido em adultos. Apesar da ausência de seguimento dos três casos, Louis et al. concluíram que, apesar da possibilidade de haver múltiplos centros de ossificação, estes coalescem e formam um escafoide único no adulto(10). Uma evidência recente da hipótese da não fusão foi publicada em 1990, quando Doman et al. relataram um caso de uma paciente com dois centros de ossificação do escafoide, bilateralmente, e posterior evolução para escafoides bipartidos, bilateralmente, com sintomas em uma menina acompanhada entre os 8,5 anos e 17 anos. A fratura do escafoide seria o diagnóstico diferencial, entretanto, ela é incomum em crianças e, quando ocorre, geralmente a divisão dos fragmentos se encontra no terço distal. Os autores concluíram que, apesar de extremamente incomum, uma das causas de divisão poderia ser congênita, por não fusão dos centros de ossificação (escafoide bipartido)(12). Os critérios de Bunnell foram descritos e atualmente são aceitos para diagnosticar escafoide bipartido: a) ausência de história de trauma; b) presença de divisão bilateral dos escafoides; c) tamanho e densidade semelhantes de ambos os componentes do escafoide; d) ausência de sinais degenerativos de ambos os componentes do escafoide ou outro sítio no punho; e) margens arredondadas e regulares de ambos os componentes do escafoide(13). Apesar de um dos pilares do diagnóstico ser a ausência de sinais degenerativos, casos foram relatados de escafoide bipartido sintomático com osteoartrose dos seus componentes(12,14,15). Portanto, o diagnóstico de um escafoide dividido pode ser desafiador, principalmente quando sintomático, pois pode representar um escafoide bipartido com alterações degenerativas ou um escafoide fraturado com pseudoartrose. OS TRIGONUM O os trigonum (Figuras 3 e 4) é um ossículo acessório posterior ao tálus, relativamente comum, podendo estar presente em cerca de 7% a 8% dos pés(16,17). O processo posterior do tálus contém dois tubérculos, o medial e o lateral, divididos pelo sulco do tendão do músculo flexor longo do hálux(18). O os trigonum se articula por uma sincondrose a um dos tubérculos do processo posterior do tálus, pode se articular com o calcâneo e, raramente, pode ser duplicado (um em cada tubérculo)(1,17,19). Foi descrito pela primeira vez por Rosenmüller em 1804(17) e considerado ossículo acessório por Gruber em 1864 e Stieda em 1869; entretanto, em 1882 foi considerado como resultado de fratura do processo posterior do tálus por Shepherd(20). No mesmo ano, o erro foi corrigido por Turner(21), mas o termo incorreto "fratura de Shepherd" ainda pode ser encontrado na literatura(1). 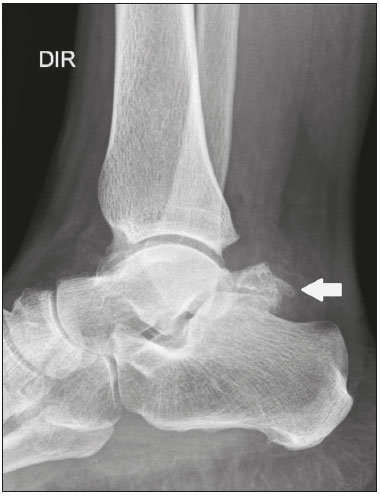 Figura 3. Radiografia do tornozelo direito em perfil demonstrando um ossículo triangular (seta), com superfície irregular, posterior ao tálus, não sendo caracterizado de maneira inequívoca espaço articular entre o ossículo e o tálus. Com a radiografia, o diagnóstico diferencial inclui o processo de Stieda e o os trigonum. 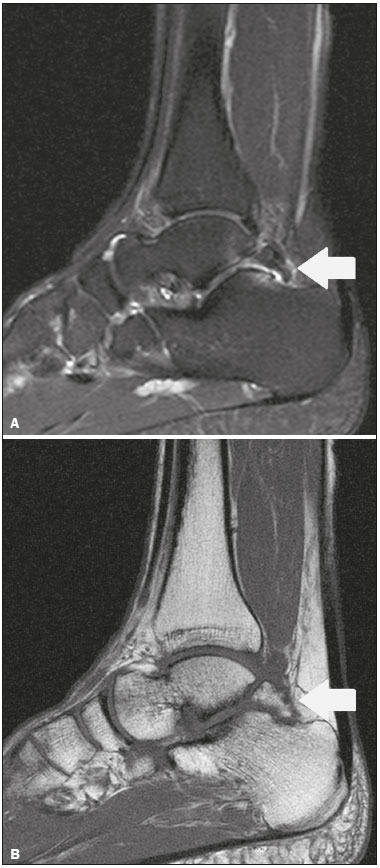 Figura 4. Cortes sagitais de ressonância magnética ponderadas em T1 (A) e T2 (B) esclarecem o diagnóstico da Figura 3, pois revelam uma articulação entre o ossículo e o tálus, compatível com os trigonum. Além da articulação, observa-se edema ósseo, sugerindo alterações inflamatórias. O mesmo núcleo de ossificação que forma o os trigonum, quando se fusiona ao processo posterior do tálus, pode criar um tubérculo mais proeminente, denominado de processo de Stieda(22). Ambos os apêndices ósseos podem causar a síndrome da compressão talar ou síndrome do impacto posterior do tornozelo, principalmente em indivíduos que realizam a flexão plantar repetida do pé(22,23). Essa síndrome ocorre em bailarinos e jogadores de futebol, pois ao manter a posição pointe e demi pointe do balé(23) ou ao chutar a bola(24), sofrem compressão de estruturas adjacentes(23), como os ligamentos talofibular posterior, intermaleolar e tibiofibular ou o próprio tendão do músculo flexor longo do hálux(22). A clínica da síndrome do impacto posterior do tornozelo inclui dor no aspecto posterolateral do tornozelo, com piora ao realizar uma vigorosa flexão plantar. A radiografia do tornozelo em perfil pode mostrar tanto o os trigonum quanto o processo de Stieda, e uma incidência adicional em flexão plantar pode ser útil para identificar impacto da protuberância óssea na tíbia(24); entretanto, as partes moles são mais bem estudadas na ressonância magnética(22). A excisão do os trigonum ou processo de Stieda geralmente é suficiente para reduzir a dor(23). O diagnóstico diferencial da síndrome da compressão talar inclui tenossinovite ou ruptura do tendão do músculo flexor longo do hálux, tenossinovite dos tendões dos músculos fibulares na porção lateral do tornozelo e tendinite do tendão do calcâneo(23). Tendo em vista a incidência dos achados nos tubérculos do processo posterior do tálus, a síndrome de compressão talar ou impacto posterior do tornozelo deve ser cogitada em pacientes com dor no tornozelo. OS ACROMIALE O os acromiale (Figuras 5 e 6) é um ossículo acessório que resulta da falha de fusão de uma das quatro epífises do acrômio(25). O acrômio dividido foi descrito pela primeira vez pelo cirurgião romano Galeno, entre os séculos II e III(26), e em 1863 Gruber descreveu três casos ao dissecar 100 cadáveres, atribuiu a causa da separação à não fusão epifisária e denominou o ossículo acessório descrito de os acromiale(26,27). Apesar dos resultados de Gruber, Struthers et al., em 1896, atribuíram a separação do acrômio em uma série de 14 dissecações cadavéricas a fraturas que, com o movimento constante da escápula contra a clavícula, não consolidaram e formaram uma articulação entre as duas porções do acrômio(28). Pouco tempo depois, anatomistas, como Gray e Cunningham, adotaram a hipótese da não fusão das epífises, porém, não descartaram a hipótese de fraturas em alguns casos(27). 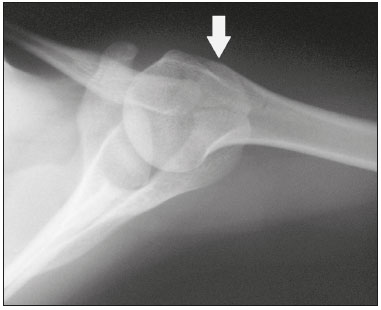 Figura 5. Radiografia em incidência axilar mostrando um ossículo triangular distal ao acrômio (seta), separado por uma linha de espessura uniforme, compatível com os acromiale. 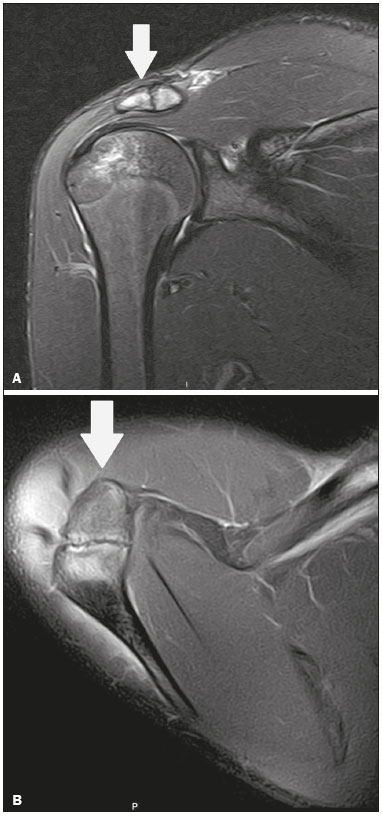 Figura 6. Cortes axial (A) e coronal (B) de ressonância do ombro direito em T2 identificando edema ósseo no os acromiale e na porção distal do acrômio, sugestivo de alterações inflamatórias. Com a finalidade de mitigar a discussão e encerrar a divergência, Liberson, em 1937, relatou 25 casos identificados em radiografias do ombro e propôs três critérios para distinguir o os acromiale de fratura: 1) bilateralidade; 2) limites arredondados e espessura da linha de clivagem entre o ossículo e o restante do acrômio uniforme; 3) posição do ossículo ao nível ou mais alta que o restante do acrômio(25). Neer, em 1972, relatou 50 casos de síndrome do impacto no ombro que foram submetidos a acromioplastia. Alguns os acromiale foram identificados durante as cirurgias e o ossículo foi atribuído como uma das causas de ruptura do manguito rotador(29). Achados semelhantes da série de oito casos de Mudge et al., em 1984, ratificaram a hipótese de ruptura do manguito rotador relacionada ao os acromiale(30). A identificação do os acromiale pode ser realizada por uma radiografia em perfil axilar, entretanto, tomografia ou ressonância podem ser necessárias para visualizar alterações degenerativas do ossículo ou indícios de lesão do manguito rotador(26,31), como edema ou calcificação no tendão do músculo supraespinal. A osteofitose das margens no os acromiale indica instabilidade que pode resultar em síndrome do impacto(32). A identificação do os acromiale no contexto da síndrome do impacto do ombro é primordial, pois, nos casos cirúrgicos, a presença do ossículo acessório pode alterar a abordagem cirúrgica(29). OS HAMULI PROPRIUM O os hamuli proprium ou hamato bipartido (Figura 7) é um ossículo acessório raro que se origina da falha de fusão do centro de ossificação do hâmulo. Quem primeiro o relatou na literatura foi Thelineus em 1896(33). Um caso em uma série de 1452 radiografias de punho (0,06%) foi relatado por Bugart em 1932(33) e 42 casos em uma série de 3218 radiografias de punho (1,3%) foram relatados por Chow et al. entre 1989 e 2002(34). 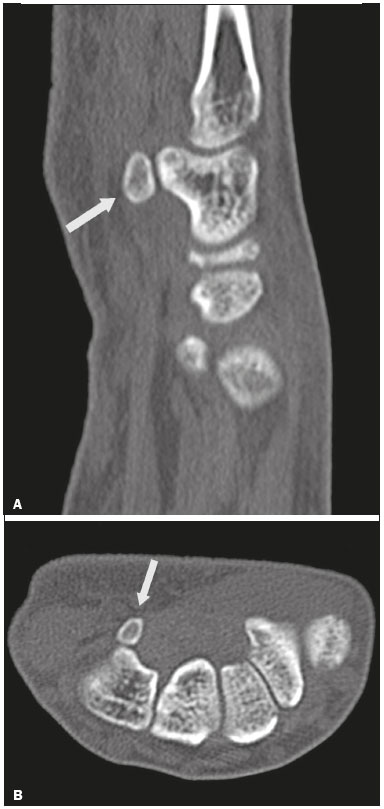 Figura 7. Cortes axial (A) e sagital (B) de tomografia do punho demonstrando, ao nível do hamato, uma separação do seu hâmulo, com contornos arredondados e regulares, sugestivo de os hamuli proprium (setas). O hâmulo do hamato é um marco importante no punho, pois delimita lateral e distalmente o canal de Guyon, o qual contém gordura, artéria, nervo e veias ulnares. Seus outros limites são o pisiforme proximal, medialmente, o ligamento carpal volar, anteriormente, e os ligamentos piso- hamato e transcarpal, posteriormente. O hâmulo serve como polia para o tendão do músculo flexor profundo do 5º dedo e sítio de inserção da borda ulnar do ligamento carpal transverso, do ligamento piso-hamato e dos músculos flexor curto do mínimo e oponente do quinto dedo. Fratura do hâmulo do hamato pode ocorrer em esportes que exijam preensão palmar de cabos de raquete ou taco (tênis, golfe, beisebol), ciclistas e operadores de britadeira(33,35). As forças de tração determinadas a um hâmulo fraturado dificultam sua fusão e favorecem a pseudoartrose(33). Portanto, a fratura com não fusão do hâmulo é o principal diagnóstico diferencial do os hamuli proprium. Dor e parestesia na eminência hipotenar com irradiação para quarto e quinto pododáctilos podem ser causadas por compressão do nervo ulnar ao nível do canal de Guyon. Essa entidade clínica foi denominada de síndrome do túnel ulnar por Dupont et al., em 1965(36). A neuropatia do nervo ulnar estava relacionada à fratura do hâmulo do hamato, até que Greene et al., em 1981, relataram um caso de hamato bipartido com a síndrome do túnel ulnar(33). A presença do os hamuli proprium também pode estar relacionada à síndrome do túnel do carpo, pois na série de Chow et al., de 2005, 95,2% dos casos de hamato bipartido também apresentavam a síndrome do túnel do carpo(34). O diagnóstico diferencial de dor na eminência hipotenar inclui: fratura ou luxação do pisiforme; fratura osteocondral do piramidal; fratura do hâmulo do hamato; tendinite do músculo flexor ulnar do carpo; tenossinovite do tendão do músculo flexor do quinto dedo; osteoartrose da articulação piso-piramidal; síndrome do túnel ulnar; síndrome do martelo hipotênar; síndrome da vibração do segmento mão-braço; cisto ganglionar; schwannoma; hemangioma; lipoma; e osteoma osteoide(35). Uma radiografia na incidência do canal do carpo pode identificar uma separação do hâmulo do hamato, porém, a tomografia pode estar indicada para distinguir entre fratura e hamato bipartido, a qual apresentará uma margem regular bem definida(33), e a ressonância pode estar indicada para avaliar o comprometimento do nervo ulnar(35). Dor na eminência hipotênar é uma queixa comum e possui um diagnóstico diferencial amplo(35). A investigação pode se iniciar com radiografias, as quais podem revelar, por exemplo, um os hamuli proprium, porém, outros métodos podem ser necessários para esclarecer o diagnóstico. NAVICULAR ACESSÓRIO TIPO 2 O navicular pode apresentar três diferentes alterações consideradas acessórias: a primeira foi descrita por Bauhin em 1605 e denominada de os tibiale externum(17). Tratava-se de um sesamoide no tendão do músculo tibial posterior, que se insere na porção posterior do tubérculo navicular. Von Luschka, em 1858, descreveu uma variação da descrição de Bauhin em um indivíduo de 17 anos. O adolescente apresentava um ossículo na região posterior do tubérculo navicular, porém, a ele articulado e envolto por cápsula articular(37). A terceira alteração foi descrita por Geist, em 1914, que encontrou 14 pés com naviculares acessórios em uma série de 100 radiografias. Desses 14 pés, os autores encontraram alguns (o número não foi informado) fusionados ao navicular, formando um tubérculo mais proeminente(17). Atualmente, o navicular acessório é classificado em: tipo 1 – quando arredondado, medindo entre 2 e 6 mm e localizado no interior do tendão do músculo tibial posterior (corresponde à descrição do os tibiale externum e foi observado em 30% dos casos); tipo 2 (Figuras 8 e 9) – quando triangular, articulado por uma ligação fibrocartilaginosa ao navicular e medindo cerca de 12 × 9 mm (corresponde à descrição de von Luschka e foi observado em 70% dos casos); tipo 3 – quando o navicular apresenta um aspecto cornuado (o tubérculo proeminente que corresponde à fusão descrita por Geist)(38). 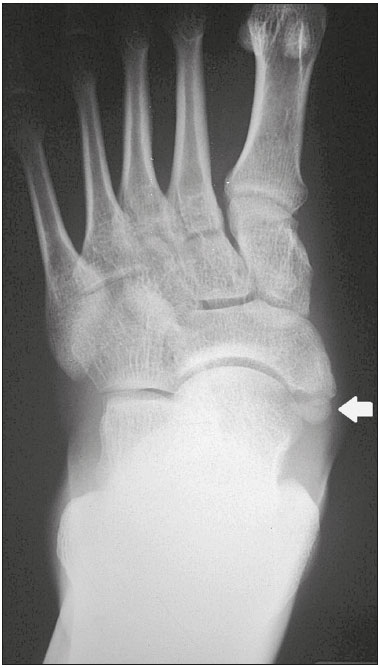 Figura 8. Radiografia anteroposterior do pé esquerdo ilustrando um ossículo triangular no aspecto posteromedial ao navicular (seta), com margens regulares e aparente articulação com o navicular, compatível com navicular acessório tipo 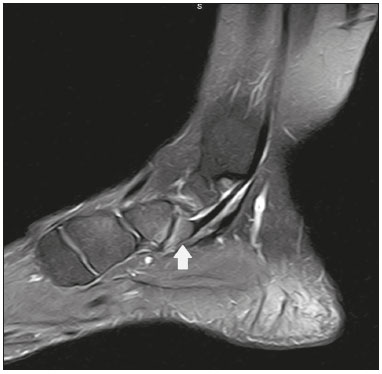 Figura 9. Corte axial de ressonância ponderada em T2 do pé mostrando a inserção do tendão do músculo tibial posterior e alterações inflamatórias no navicular acessório (seta). Veitch, em 1978, relatou uma série de 21 pacientes com dor no aspecto medial do pé. Cerca de 91% dos pés sintomáticos apresentavam um navicular acessório tipo 2, os 9% dos pés sintomáticos restantes apresentavam um navicular acessório tipo 3 e vários outros pés assintomáticos (número não informado) apresentavam um navicular acessório tipo 1(39). Outros autores encontraram a mesma associação entre sintomas e o navicular acessório tipo 2(38) e observaram que esse tipo pode evoluir para osteonecrose nos pacientes sintomáticos(33,40). A radiografia do pé pode identificar e classificar o tipo de navicular acessório, porém, a ressonância pode ser necessária nos casos sintomáticos para identificar sinais de edema ósseo e alterações de partes moles adjacentes, como comprometimento da sincondrose e do tendão do músculo tibial posterior(40,41). PATELA BIPARTIDA TIPO 1 A patela é considerada um sesamoide que funciona como polia, facilitando a extensão do joelho(42). Gruber, em 1883, descreveu o primeiro relato de uma patela dividida no ângulo superolateral e denominou a alteração de patela bipartida. Outros casos foram relatados na literatura e a causa da divisão era atribuída a fratura, até que, em 1921, Todd e McCally sugeriram que a patela poderia se originar de mais de um centro de ossificação e que uma patela dividida poderia ser causada por uma anomalia de fusão desses centros(43). George, em 1935, relatou um caso de patela bipartida encontrada bilateralmente ao dissecar um homem de 63 anos. Ao analisar histologicamente os fragmentos da patela, encontrou íntegras a cápsula patelar e a cartilagem entre os fragmentos, sem evidências de fibrose que sugerissem fratura prévia. Com esse achado, ele propôs que a diferenciação entre a causa adquirida (fratura) e a causa congênita poderia ser realizada pela análise histológica dos fragmentos. Na patela fraturada haveria uma interrupção da cápsula patelar e da cartilagem articular entre os fragmentos, porém, a patela bipartida apresentaria cápsula e cartilagem articular íntegras(43). A patela bipartida ocorre em até 2% a 3% da população, acomete mais homens em uma proporção de 9:1 e é bilateral em aproximadamente 50% dos casos(44,45). Saupe, em 1943, propôs uma classificação dos tipos de patela bipartida de acordo com a localização do fragmento acessório: tipo I (Figura 10) – quando se encontra no polo inferior da patela (5% dos casos); tipo II – quando é lateral (20% dos casos); tipo III – quando é superolateral à patela (75% dos casos)(44). 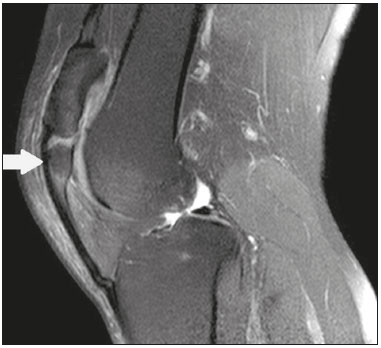 Figura 10. Corte sagital de ressonância ponderada em T2 do joelho demonstrando um fragmento ósseo na porção inferior da patela (seta), junto à inserção do tendão patelar, contendo discreto aumento de sinal sugestivo de atividade inflamatória, compatível com ou patela bipartida tipo I ou doença de Sinding-Larsen-Johansson. Acreditava-se que a patela bipartida era uma variação anatômica assintomática, até que Weaver, em 1977, relatou 21 casos sintomáticos, todos com a patela bipartida tipo III de Saupe. A maior parte dos casos era de atletas jovens com gonalgia durante ou após exercício intenso, sem outra causa provável e com melhora dos sintomas após excisão do fragmento acessório. A causa da dor foi atribuída a mobilidade anormal da sincondrose encontrada entre os fragmentos na cirurgia(44). O fragmento acessório geralmente pode ser identificado em radiografias, nas incidências anteroposterior e axial de patela, ou em tomografia; no entanto, a ressonância é necessária para esclarecer o diagnóstico, pois pode demonstrar edema no fragmento acessório e nas margens da sincondrose, entre os fragmentos, nos pacientes sintomáticos(45). Apesar do estabelecimento, na literatura, da hipótese de não fusão congênita dos núcleos de ossificação da patela, há relatos de patelas supostamente bipartidas em adultos com gonalgia que tinham radiografias prévias mostrando patelas normais. Isso poderia sugerir, segundo Lawson, que o fragmento acessório responsável pela dor, na realidade, representa uma disrupção condro-óssea por tensão crônica, em vez de alterações degenerativas de uma sincondrose congênita(46,47). Essa fisiopatologia se assemelha aos achados da doença de Osgood-Schlatter (lesão por tração na tuberosidade tibial, ao nível da inserção do tendão patelar, que pode causar uma fragmentação da porção tibial afetada) e da doença de Sinding-Larsen-Johansson (lesão de tração no polo inferior da patela, ao nível da inserção do tendão patelar, que pode causar uma fragmentação da porção patelar afetada, diagnóstico diferencial para patela bipartida tipo I)(46–48). Portanto, a causa da patela bipartida ainda não está totalmente esclarecida. O diagnóstico diferencial da patela bipartida sintomática inclui doença de Sinding-Larsen-Johansson, doença de Osgood-Schlatter, joelho de saltador (tendinite patelar) e fratura em luva da patela (fratura por avulsão do polo inferior da patela)(48). A maior parte dos casos relatados de patela bipartida sintomática ocorre nos tipos II e III de Saupe. Os únicos relatos encontrados na literatura de patela tipo I sintomática consistem na série de quatro casos de Okuno et al., que descreveram casos de separação traumática da patela bipartida(49). Isso deve ocorrer pela baixa frequência do tipo (5% dos casos relatados(44)) e pela sobreposição com a síndrome de Sinding-Larsen-Johansson – ambas as condições acometem sobretudo jovens do sexo masculino que praticam atividade física e apresentam gonalgia e um fragmento no aspecto inferior da patela(44). Provavelmente, a única forma de distingui-las seria por meio de exames prévios: patela previamente dividida se bipartida ou patela previamente normal se Sinding-Larsen-Johansson. Há quem defenda que não existe um centro separado de ossificação no inferior da patela e que os casos de patela supostamente bipartida do tipo I são, na verdade, sequela da doença de Sinding-Larsen-Johansson ou sua forma assintomática(46,50). REFERÊNCIAS 1. O''Rahilly R. A survey of carpal and tarsal anomalies. J Bone Joint Surg Am. 1953;35-A:626–42. 2. Mellado JM, Ramos A, Salvadó E, et al. Accessory ossicles and sesamoid bones of the ankle and foot: imaging findings, clinical significance and differential diagnosis. Eur Radiol. 2003;13 Suppl 6:L164–77. 3. Dameron TB. Fractures and anatomical variations of the proximal portion of the fifth metatarsal. J Bone Joint Surg Am. 1975;57:788–92. 4. Coskun N, Yuksel M, Cevener M, et al. Incidence of accessory ossicles and sesamoid bones in the feet: a radiographic study of the Turkish subjects. Surg Radiol Anat. 2009;31:19–24. 5. Boya H, Oztekin HH, Ozcan O. Abnormal proximal fifth metatarsal and os vesalianum pedis. J Am Podiatr Med Assoc. 2007;97:428–9. 6. Peterson JJ, Bancroft LW. Os peroneal fracture with associated peroneus longus tendinopathy. AJR Am J Roentgenol. 2001;177:257–8. 7. Kishan TV, Mekala A, Bonala N, et al. Iselin''s disease: traction apophysitis of the fifth metatarsal base, a rare cause of lateral foot pain. Med J Armed Forces India. 2016;72:299–301. 8. Theodorou DJ, Theodorou SJ, Kakitsubata Y, et al. Fractures of proximal portion of fifth metatarsal bone: anatomic and imaging evidence of a pathogenesis of avulsion of the plantar aponeurosis and the short peroneal muscle tendon. Radiology. 2003;226:857–65. 9. Jones RI. Fracture of the base of the fifth metatarsal bone by indirect violence. Ann Surg. 1902;35:697–700. 10. Louis DS, Calhoun TP, Garn SM, et al. Congenital bipartite scaphoid—fact or fiction? J Bone Joint Surg Am. 1976;58:1108–12. 11. Dwight T. The clinical significance of variations of wrist and ankle. J Am Med Assoc. 1906;47:252–5. 12. Doman AN, Marcus NW. Congenital bipartite scaphoid. J Hand Surg Am. 1990;15:869–73. 13. Boyes JH. Bunnell''s surgery of the hand. 5th ed. Philadelphia, PA: JB Lippincott; 1970. 14. Richards RR, Ledbtter WS, Transfeldt EE. Radiocarpal osteoarthritis associated with bilateral bipartite carpal scaphoid bones: a case report. Can J Surg. 1987;30:289–91. 15. Kim SB, Kim WS, Chung WY, et al. Bilateral bipartite carpal scaphoid – a case report. J Korean Orthop Assoc. 2005;40:614–6. 16. Dwight T. A clinical atlas. Variations of the bones of the hands and feet. Philadelphia & London: JB Lippincott; 1907. 17. Geist ES. Supernumerary bones of the foot—a röntgen study of the feet of one hundred normal individuals. J Bone Joint Surg. 1915;12:403–14. 18. Berkowitz MJ, Kim DH. Process and tubercle fractures of the hindfoot. J Am Acad Orthop Surg. 2005;13:492–502. 19. Grogan DP, Walling AK, Ogden JA. Anatomy of the os trigonum. J Pediatr Orthop. 1990;10:618–22. 20. Shepherd FJ. A hitherto undescribed fracture of the astragalus. J Anat Physiol. 1882;17(Pt 1):79–81. 21. Turner W. A secondary astragalus in the human foot. J Anat Physiol. 1882;17(Pt 1);82–3. 22. Robinson P, White LM. Soft-tissue and osseous impingement syndromes of the ankle: role of imaging in diagnosis and management. Radiographics. 2002;22:1457–69. 23. Quirk R. Talar compression syndrome in dancers. Foot Ankle. 1982;3:65–8. 24. Brodsky AE, Khalil MA. Talar compression syndrome. Foot Ankle. 1987;7:338–44. 25. Liberson F. Os acromiale: a contested anomaly. J Bone Joint Surg Am. 1937;19:683–9. 26. Corradi AWC, Pascarelli L, Bongiovanni RR, et al. Tratamento cirúrgico para os acromiale sintomático. Arq Bras Ciênc Saúde. 2010; 35:41–5. 27. McClure JG, Raney RB. Anomalies of the scapula. Clin Orthop Relat Res. 1975;(110):22–31. 28. Struthers J. On separate acromion process simulating fracture. Edinb Med J. 1896;41:1088–104. 29. Neer CS 2nd. Impingement lesions. Clin Orthop Relat Res. 1983; (173):70–7. 30. Mudge MK, Wood VE, Frykman GK. Rotator cuff tears associated with os acromiale. J Bone Joint Surg Am. 1984;66:427–9. 31. Warner JJ, Beim GM, Higgins L. The treatment of symptomatic os acromiale. J Bone Joint Surg Am. 1998;80:1320–6. 32. Park JG, Lee JK, Phelps CT. Os acromiale associated with rotator cuff impingement: MR imaging of the shoulder. Radiology. 1994; 193:255–7. 33. Greene MH, Hadied AM. Bipartite hamulus with ulnar tunnel syndrome—case report and literature review. J Hand Surg Am. 1981;6:605–9. 34. Chow JC, Weiss MA, Gu Y. Anatomic variations of the hook of hamate and the relationship to carpal tunnel syndrome. J Hand Surg Am. 2005;30:1242–7. 35. Blum AG, Zabel JP, Kohlmann R, et al. Pathologic conditions of the hypothenar eminence: evaluation with multidetector CT and MR imaging. Radiographics. 2006;26:1021–44. 36. Dupont C, Cloutier GE, Prevost Y, et al. Ulnar-tunnel syndrome at the wrist. A report of four cases ulnar-nerve compression at the wrist. J Bone Joint Surg Am. 1965;47:757–61. 37. Zadek I, Gold AM. The accessory tarsal scaphoid. J Bone Joint Surg Am. 1948;30-A:957–68. 38. Lawson JP, Ogden JA, Sella E, et al. The painful accessory navicular. Skeletal Radiol. 1984;12:250–62. 39. Veitch JM. Evaluation of the Kidner procedure in treatment of symptomatic accessory tarsal scaphoid. Clin Orthop Relat Res. 1978;(131):210–3. 40. Choi YS, Lee KT, Kang HS, et al. MR imaging findings of painful type II accessory navicular bone: correlation with surgical and pathologic studies. Korean J Radiol. 2004;5:274–9. 41. Miller TT, Staron RB, Feldman F, et al. The symptomatic accessory tarsal navicular bone: assessment with MR imaging. Radiology. 1995;195:849–53. 42. Brooke R. The treatment of fractured patella by excision. A study of morphology and function. BJS. 1937;24:733–47. 43. George R. Bilateral bipartite patellae. Br J Surg. 1935;22:555–60. 44. Weaver JK. Bipartite patellae as a cause of disability in the athlete. Am J Sports Med. 1977;5:137–43. 45. Kavanagh EC, Zoga A, Omar I, et al. MRI findings in bipartite patella. Skeletal Radiol. 2007;36:209–14. 46. Ogden JA, McCarthy SM, Jokl P. The painful bipartite patella. J Pediatr Orthop. 1982;2:263–9. 47. Lawson JP. Symptomatic radiographic variants in extremities. Radiology. 1985;157:625–31. 48. Stevens MA, El-Khoury GY, Kathol MH, et al. Imaging features of avulsion injuries. Radiographics. 1999;19:655–72. 49. Okuno H, Sugita T, Kawamata T, et al. Traumatic separation of a type I bipartite patella: a report of four knees. Clin Orthop Relat Res. 2004;(420):257–60. 50. Freedman DM, Kono M, Johnson EE. Pathologic patellar fracture at the site of an old Sinding-Larsen-Johansson lesion: a case report of a 33-year-old male. J Orthop Trauma. 2005;19:582–5. 1. Médico Residente em Radiologia e Diagnóstico por Imagem do Hospital Nossa Senhora das Graças, Curitiba, PR, Brasil 2. Médico Radiologista, Preceptor de Residência em Radiologia e Diagnóstico por Imagem do Hospital Nossa Senhora das Graças, Curitiba, PR, Brasil Trabalho realizado no Hospital Nossa Senhora das Graças, Curitiba, PR, Brasil. Endereço para correspondência: Dr. André Vaz Hospital Nossa Senhora das Graças – Radiologia Rua Alcides Munhoz, 433, Mercês Curitiba, PR, Brasil, 80810-040 E-mail: andrevaz7@gmail.com Recebido para publicação em 25/8/2017 Aceito, após revisão, em 16/11/2017 |
|
Av. Paulista, 37 - 7° andar - Conj. 71 - CEP 01311-902 - São Paulo - SP - Brazil - Phone: (11) 3372-4544 - Fax: (11) 3372-4554