Radiologia Brasileira - Publicação Científica Oficial do Colégio Brasileiro de Radiologia
AMB - Associação Médica Brasileira CNA - Comissão Nacional de Acreditação
 Vol. 52 nº 1 - Jan. / Fev. of 2019
Vol. 52 nº 1 - Jan. / Fev. of 2019
|
ARTIGO DE REVISÃO
|
|
|
|
|
Autho(rs): Carla Chizuru Tajima1,a; Luiza Lourenço Campos de Sousa2,b; Gustavo Lagreca Venys3,c; Camila Souza Guatelli4,d; Almir Galvão Vieira Bitencourt5,e; Elvira Ferreira Marques6,f |
|
|
Descritores: Radiologia; Carcinoma intraductal não infiltrante; Ressonância magnética; Neoplasias da mama. |
|
|
Resumo: INTRODUÇÃO
O câncer de mama é a neoplasia maligna mais comum entre as mulheres e o segundo tipo de câncer mais frequente no mundo, tanto em países desenvolvidos quanto em países em desenvolvimento, representando cerca de 25% de todos os casos de câncer no Brasil, de acordo com o Instituto Nacional de Câncer(1–3). O carcinoma ductal in situ (CDIS) é uma doença heterogênea constituída por células epiteliais malignas com origem na unidade ductolobular terminal que não ultrapassam a membrana basal. É considerado uma lesão precursora e possui risco para o desenvolvimento de neoplasia mamária invasiva(4–6). A detecção precoce do CDIS aumentou significativamente com o uso da mamografia de rastreamento em meados da década de 1980 nas mulheres acima de 40 anos, com sensibilidade de 60% a 90%(7,8). A ressonância magnética (RM) das mamas, popularizada na década de 1990, permite distinguir o tecido normal do câncer por meio do aumento da vascularização e permeabilidade capilar de lesões malignas e pode ser considerado um exame complementar à mamografia, principalmente na avaliação de doença sem calcificações e na avaliação da extensão tumoral(2,6). A RM apresenta alta sensibilidade para o diagnóstico de CDIS, principalmente para os de alto grau(5). O objetivo deste trabalho é discutir e ilustrar as formas de apresentação do CDIS nas imagens de RM, além de revisar a eficácia desse método na sua detecção precoce e avaliação da extensão da doença. MATERIAIS E MÉTODOS A seleção de artigos para este estudo foi realizada utilizando processo de busca em publicações de língua inglesa dos trabalhos apresentando exames de imagem na avaliação do CDIS, aplicando-se as seguintes palavras-chaves, em inglês, nas bases de dados Medline/PubMed, Lilacs e SciELO: DCIS, image e breast MRI. Considerando-se a avaliação do CDIS por exames de imagem, foram selecionadas publicações entre os anos 2000 e 2018 e obtidos 28 artigos que apresentaram informações descritivas relacionadas ao aspecto radiológico do CDIS, incluindo RM. Foram avaliados, ainda, retrospectivamente, exames de imagem de pacientes com diagnóstico de CDIS submetidas a RM em um centro de referência em oncologia. DISCUSSÃO Aspectos clinicopatológicos O CDIS é uma lesão heterogênea considerada forma pré-invasiva do câncer de mama, e entre os tipos não invasivos é o mais comum. Possui alto potencial de evolução para doença invasiva em cerca de 30% a 50% dos casos(6), principalmente os subtipos com alto grau nuclear, que podem progredir para câncer invasivo, requerendo tratamento cirúrgico. Clinicamente, o CDIS é assintomático na maioria das pacientes, sendo achado incidental de imagem nos exames de rotina, principalmente pelas microcalcificações na mamografia. Com os programas de rastreamento por mamografia e a melhoria da qualidade dos exames de imagem, sua detecção precoce aumentou em cerca de 20%(5). A classificação morfológica do CDIS em grau nuclear é dividida em grupos de baixo grau, grau intermediário e alto grau. Os tumores de baixo grau são bem diferenciados e sem necrose, os de grau intermediário são bem ou moderadamente diferenciados e possuem áreas de necrose, e os de alto grau nuclear são pouco diferenciados, apresentam áreas de necrose e alto índice de proliferação celular. Os subtipos arquiteturais incluem o padrão do tipo cribriforme, micropapilar, sólido, misto e comedocarcinoma. O comedocarcinoma possui o pior prognóstico, com grande quantidade de células atípicas e extensa área com detritos necróticos, envoltos pela camada de células com atipia, frequentemente com microcalcificações e numerosas mitoses(9–11). O alto grau nuclear do CDIS está associado a um pior prognóstico da doença e, quando associado a comedonecrose, pode correlacionar-se a um maior risco de recorrência local após exérese cirúrgica. Apresentação do CDIS nos métodos convencionais (mamografia e ultrassonografia) Nas imagens de mamografia, o CDIS apresenta-se, na maioria dos casos, por microcalcificações de morfologias variadas, como as amorfas, grosseiras, heterogêneas ou pleomórficas finas, e estas, por sua vez, possuem o maior grau de suspeição para lesões de alto grau. A distribuição das microcalcificações pela mama é variada e pode ser encontrada nas formas agrupadas, lineares ou segmentares (Figura 1). Em menor proporção, podem aparecer como massas ou áreas de distorção arquitetural(11,12). 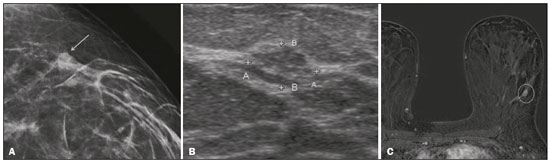 Figura 1. A: Mamografia com compressão focal em craniocaudal mostrando imagem nodular ovalada com margens irregulares e microcalcificações amorfas de permeio localizada no terço posterior do quadrante superolateral da mama esquerda (seta). B: Ultrassonografia da mama esquerda demonstrando imagem nodular ovalada, com margens indistintas e imagens ecogênicas de permeio sugestivas de microcalcificações, localizada às 2h00/3h00 da mama esquerda, com correspondência à imagem nodular do quadrante superolateral descrita no exame mamográfico. C: RM das mamas em corte axial na sequência com subtração mostrando o nódulo irregular do quadrante superolateral da mama esquerda. Estudo anatomopatológico: CDIS, tipos sólido e cribriforme, graus nucleares 2 e 3, com focos de diferenciação apócrina. O exame ultrassonográfico pode ser útil na detecção do CDIS, principalmente na avaliação de massas com calcificações visualizadas na mamografia, aumentando a especificidade desse método (Figura 1B). A área não calcificada pode representar o componente invasivo da lesão(9). Apresentação do CDIS na RM Nos últimos anos, a RM das mamas vem sendo frequentemente utilizada como método complementar a mamografia e ultrassonografia. A RM apresenta alta sensibilidade para a detecção do CDIS puro ou associado a carcinoma invasivo (Figura 2), auxiliando principalmente na avaliação do componente não calcificado da doença, na avaliação da extensão tumoral, de doença residual, no tumor primário oculto, na detecção de tumores multifocais, multicêntricos e contralaterais, na avaliação da resposta a quimioterapia neoadjuvante, no estadiamento pré-operatório e na avaliação dos achados inconclusivos dos exames mamográficos(11,13). 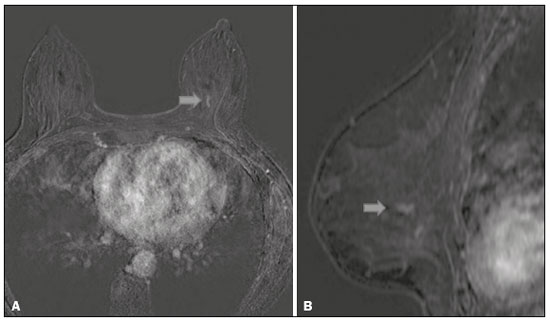 Figura 2. RM em corte axial na fase de subtração (A) e em corte sagital (B) pós-contraste em alta resolução demonstrando área de realce de distribuição linear (setas) localizada no terço posterior da região central/junção dos quadrantes mediais da mama esquerda. Estudo anatomopatológico da peça cirúrgica: CDIS, grau nuclear 2. A RM é útil na detecção do CDIS, especialmente os de alto grau, mesmo nos casos em que a mamografia está normal. A sensibilidade para a detecção de CDIS varia amplamente, de 60% para 100%, principalmente quando associada a sequências de alta resolução, podendo ser útil para os CDISs calcificados ou não calcificados(10,14–17). As lesões puras de CDIS mostram realce não nodular em 59% dos casos, enquanto 14% realçam como nódulo, 14% não realçam e 12% se apresentam como um foco(18). Em contraste, as lesões associadas ao carcinoma invasivo e CDIS realçam como nódulo em 76% dos casos(14). Um estudo de Kuhl et al., realizado para avaliação do CDIS, demonstrou que a sensibilidade da RM foi muito superior à da mamografia, sendo 92% contra 56%, na detecção de CDIS. Esse estudo revelou, ainda, que a maioria das lesões não detectadas na RM foi de baixo grau (87%). A melhoria na detecção de CDIS em estudos recentes provavelmente deve-se à melhoria da resolução espacial e temporal utilizada nas sequências de alta resolução(5). Um estudo recente do mesmo grupo demonstrou que a sensibilidade da RM é superior à dos métodos convencionais para o diagnóstico de CDIS de baixo grau (74,0% × 40,7%), grau intermediário (84,1% × 34,9%) e alto grau (91,8% × 36,7%), sendo essa diferença maior neste último grupo(19). O padrão de apresentação mais comum do CDIS na RM é o realce não nodular, podendo ainda mostrar-se como massa ou foco. Os tipos de distribuição variam de segmentar, linear/ductal, focal, difusa e regional. O CDIS de alto grau manifesta-se mais frequentemente como áreas de realce não nodular (60% a 81%) com padrão interno heterogêneo e de distribuição segmentar (Figuras 3 e 4)(20). 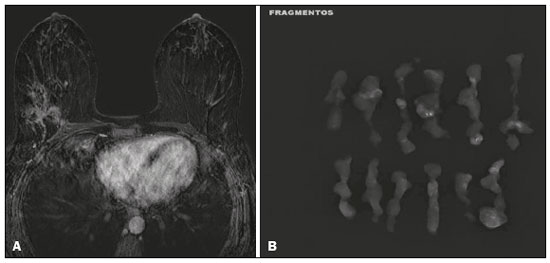 Figura 3. A: RM das mamas em corte axial na fase de subtração mostrando área de realce não nodular de distribuição segmentar, com padrão interno heterogêneo, localizada no quadrante superolateral/junção dos quadrantes laterais da mama direita, com correspondência à área de microcalcificações pleomórficas finas de distribuição segmentar descrita no exame mamográfico. B: A figura mostra fragmentos da biópsia percutânea a vácuo guiada por estereotaxia, com presença das microcalcificações. Estudo anatomopatológico: CDIS, tipos cribriforme, comedocarcinoma emicropapilar, grau nuclear 3, com extensão para lóbulos. Necrose: presente, tipo comedonecrose. 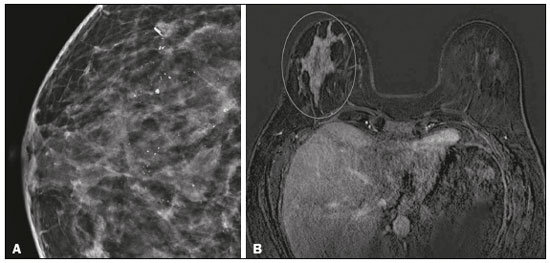 Figura 4. A: Mamografia em craniocaudal magnificada demonstrando extenso grupamento de microcalcificações grosseiramente heterogêneas de distribuição segmentar na mama direita, com clipe metálico de biópsia de permeio. B: RM das mamas em corte axial na fase de subtração mostrando área de realce não nodular, heterogênea, de distribuição segmentar com tênue realce pós-contraste, ocupando o quadrante inferolateral da mama direita, com correspondência ao achado descrito no exame mamográfico. A paciente foi submetida a mastectomia e o estudo anatomopatológico resultou em CDIS grau A B nuclear 3 com cancerização de lóbulos. As curvas cinéticas podem ser classificadas como persistentes, com aumento do sinal ao longo do tempo (curva tipo I); platô, em que a intensidade do sinal não se altera com o decorrer do tempo (curva tipo II); e lavagem ou washout, com queda do sinal ao longo do tempo (curva tipo III), sendo as curvas tipos II e III as formas mais comuns do CDIS(6). O CDIS puro não calcificado pode ser sintomático, principalmente em pacientes com mamas densas, cuja avaliação mamográfica é mais difícil, apresentando-se como massas palpáveis ou com queixa de descarga papilar. Na mamografia podem apresentar-se como assimetrias focais ou distorção arquitetural, e no ultrassom, como massas hipoecogênicas com margens indistintas, anguladas ou espiculadas. Na RM, sua apresentação é variável, porém, grande parte mostra-se como nódulo e realce não nodular e as curvas tipos II e III prevalecem. Com relação ao grau nuclear do CDIS não calcificado, não há consenso definido, mas sugere-se que devam apresentar mais frequentemente alto grau nuclear e comedonecrose(21,22). A sequência de difusão, amplamente utilizada na avaliação de doenças intracranianas, desde a década de 1990, pode ser utilizada também para avaliação de alterações extracranianas. Com base no movimento aleatório das moléculas de água no tecido biológico, pode-se calcular o coeficiente de difusão aparente (apparent diffusion coefficient – ADC)(23). Nos tumores de mama, a proliferação celular restringe a movimentação das moléculas de água, reduzindo os valores de ADC(24,25). Estudos mostram que o CDIS possui valores de ADC inferiores aos do tecido fibroglandular normal e significativamente acima dos valores do carcinoma ductal invasivo(26). Entretanto, o CDIS é uma lesão heterogênea, com componentes de alto e baixo grau coexistindo dentro de uma única lesão, cuja classificação é geralmente determinada pelo componente mais alto (Figura 5). 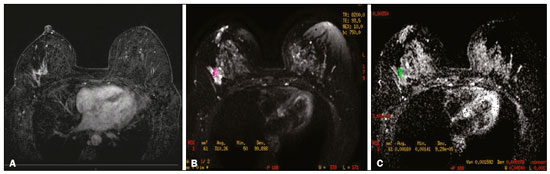 Figura 5. RM das mamas em corte axial na fase de subtração (A) demonstrando área de realce não nodular com realce heterogêneo ao meio de contraste e de distribuição segmentar, localizada no terço posterior do quadrante superolateral da mama direita. A imagem em B mostra restrição à difusão no mapa de ADC (C), sendo realizado cálculo de valor de ADC com resultado de 1,6 × 10–3 mm2/s. A paciente foi submetida a quadrantectomia e o estudo anatomopatológico resultou em CDIS, grau nuclear 1, com hiperplasia ductal atípica. A avaliação da extensão da lesão é fundamental para o planejamento terapêutico e redução do risco de recorrência da doença, e estudos mostram que a RM é mais confiável que a mamografia para avaliar o tamanho do CDIS, contribuindo para um melhor resultado operatório com a retirada da área acometida sem margens comprometidas e, consequentemente, com menor chance de recidiva local(13,21–26). A RM também pode demonstrar o componente não invasivo em carcinomas invasivos diagnosticados nos outros métodos, contribuindo para uma melhor definição da real extensão da doença(20). A presença de componente intraductal extenso no carcinoma invasivo está associada a pior prognóstico e a uma maior taxa de superestimação do tamanho do tumor na RM, quando comparada à avaliação patológica, que só inclui o componente invasivo do tumor(26–28). CONCLUSÃO A apresentação do CDIS nos exames de imagem pode ser muito variável, sendo um dilema para o radiologista. Dessa forma, a RM tem importante papel na detecção do CDIS e, principalmente, na avaliação da sua extensão, contribuindo para uma exérese cirúrgica mais confiável e reduzindo as recidivas locais. Portanto, é fundamental que os médicos radiologistas reconheçam seus principais tipos de apresentação e utilizem os recursos complementares desse exame, como a análise das curvas cinéticas e sequências como a difusão e, assim, possam fazer a correlação adequada com os outros métodos de imagem, como a mamografia e a ultrassonografia, a fim de obter uma detecção mais precoce da doença e instituir tratamento adequado. REFERÊNCIAS 1. Brasil. Ministério da Saúde. Instituto Nacional de Câncer. Estimativa 2018: incidência de câncer no Brasil. [cited 2019 Jan 15]. Available from: http://www1.inca.gov.br/estimativa/2018/estimativa-2018.pdf. 2. Brasil. Ministério da Saúde. Instituto Nacional de Câncer. Diretrizes para a detecção precoce do câncer de mama no Brasil. Rio de Janeiro, RJ: INCA; 2015. 3. Freitas-Junior R, Rodrigues DCN, Corrêa RS, et al. Contribution of the Unified Health Care System to mammography screening in Brazil, 2013. Radiol Bras. 2016;49:305–10. 4. World Health Organization. Breast cancer: prevention and control. [cited 2018 Jan 20]. Available from: http://www.who.int/cancer/detection/breastcancer/en/. 5. Kuhl CK, Schrading S, Bieling HB, et al. MRI for diagnosis of pure ductal carcinoma in situ: a prospective observational study. Lancet. 2007;370:485–92. 6. Newstead GM. MR imaging of ductal carcinoma in situ. Magn Reson Imaging Clin N Am. 2010;18:225–40. 7. Zuiani C, Londero V, Linda A, et al. MRI in B3 lesions, low grade DCIS, high DCIS: is MR selecting the dangerous cases? Eur J Radiol. 2012;81 Suppl 1:S189–91. 8. Sinha S, Lucas-Quesada FA, Sinha U, et al. In vivo diffusion-weighted MRI of the breast: potential for lesion characterization. J Magn Reson Imaging. 2002;15:693–704. 9. Parikh U, Chhor CM, Mercado CL. Ductal carcinoma in situ: the whole truth. AJR Am J Roentgenol. 2018;210:246–55. 10. Viehweg P, Lampe D, Buchmann J, et al. In situ and minimally invasive breast cancer: morphologic and kinetic features on contrast-enhanced MR imaging. MAGMA. 2000;11:129–37. 11. França LKL, Bitencourt AGV, Paiva HLS, et al. Role of magnetic resonance imaging in the planning of breast cancer treatment strategies: comparison with conventional imaging techniques. Radiol Bras. 2017;50:76–81. 12. Mossa-Basha M, Fundaro GM, Shah BA, et al. Ductal carcinoma in situ of the breast: MR imaging findings with histopathologic correlation. Radiographics. 2010;30:1673–87. 13. Chan S, Chen JH, Agrawal G, et al. Characterization of pure ductal carcinoma in situ on dynamic contrast-enhanced MR imaging: do nonhigh grade and high grade show different imaging features? J Oncol. 2010;2010. pii:431341. 14. Rosen EL, Smith-Foley SA, DeMartini WB, et al. BI-RADS MRI enhancement characteristics of ductal carcinoma in situ. Breast J. 2007;13:545–50. 15. Fisher B, Dignam J, Wolmark N, et al. Tamoxifen in treatment of intraductal breast cancer: National Surgical Adjuvant Breast and Bowel Project B-24 randomised controlled trial. Lancet. 1999;353:1993–2000. 16. Berg WA, Gutierrez L, NessAiver MS, et al. Diagnostic accuracy of mammography, clinical examination, US, and MR imaging in preoperative assessment of breast cancer. Radiology. 2004;233: 830–49. 17. Uematsu T, Yuen S, Kasami M, et al. Comparison of magnetic resonance imaging, multidetector row computed tomography, ultrasonography, and mammography for tumor extension of breast cancer. Breast Cancer Res Treat. 2008;112:461–74. 18. Liberman L, Morris EA, Dershaw DD, et al. MR imaging of the ipsilateral breast in women with percutaneously proven breast cancer. AJR Am J Roentgenol. 2003;180:901–10. 19. Kuhl CK, Strobel K, Bieling H, et al. Impact of preoperative breast MR imaging and MR-guided surgery on diagnosis and surgical outcome of women with invasive breast cancer with and without DCIS component. Radiology. 2017;284:645–55. 20. Jansen SA, Newstead GM, Abe H, et al. Pure ductal carcinoma in situ: kinetic and morphologic MR characteristics compared with mammographic appearance and nuclear grade. Radiology. 2007;245:684–91. 21. Scott-Moncrieff A, Sullivan ME, Mendelson EB, et al. MR imaging appearance of noncalcified and calcified DCIS. Breast J. 2018;24:343–9. 22. Kim JH, Ko ES, Kim DY, et al. Non-calcified ductal carcinoma in situ: imaging and histologic findings in 36 tumors. J Ultrasound Med. 2009;28:903–10. 23. Greenwood HI, Heller SL, Kim S, et al. Ductal carcinoma in situ of the breasts: review of MR imaging features. Radiographics. 2013; 33:1569–88. 24. Arantes Pereira FP, Martins G, Figueiredo E, et al. The use of diffusion-weighted magnetic resonance imaging in the differentiation between benign and malignant breast lesions. Radiol Bras. 2009;42:283–8. 25. Mori N, Ota H, Mugikura S, et al. Detection of invasive components in cases of breast ductal carcinoma in situ on biopsy by using apparent diffusion coefficient MR parameters. Eur Radiol. 2013;23:2705–12. 26. Guatelli CS, Bitencourt AGV, Osório CABT, et al. Can diffusion-weighted imaging add information in the evaluation of breast lesions considered suspicious on magnetic resonance imaging? Radiol Bras. 2017;50:291–8. 27. França LKL, Bitencourt AGV, Osório CABT, et al. Tumor size assessment of invasive breast cancers: which pathological features affect MRI-pathology agreement? Applied Cancer Research. 2018;38(2). 28. Rominger M, Berg D, Frauenfelder T, et al. Which factors influence MRI-pathology concordance of tumour size measurements in breast cancer? Eur Radiol. 2016;26:1457–65. 1. Departamento de Imagem – A.C.Camargo Cancer Center, São Paulo, SP, Brasil; a. https://orcid.org/0000-0002-9260-2505 2. Departamento de Imagem – A.C.Camargo Cancer Center, São Paulo, SP, Brasil; b. https://orcid.org/0000-0002-5576-9197 3. Departamento de Imagem – A.C.Camargo Cancer Center, São Paulo, SP, Brasil; c. https://orcid.org/0000-0003-2563-1477 4. Departamento de Imagem – A.C.Camargo Cancer Center, São Paulo, SP, Brasil; d. https://orcid.org/0000-0003-3350-5489 5. Departamento de Imagem – A.C.Camargo Cancer Center, São Paulo, SP, Brasil; e. https://orcid.org/0000-0003-0192-9885 6. Departamento de Imagem – A.C.Camargo Cancer Center, São Paulo, SP, Brasil ; f. https://orcid.org/0000-0001-7572-9371 Correspondência: Dra. Carla Chizuru Tajima Departamento de Imagem – A.C.Camargo Cancer Center Rua Professor Antonio Prudente, 211, Liberdade São Paulo, SP, Brasil, 09015-010 E-mail: carlatajima@gmail.com Recebido para publicação em 14/5/2018 Aceito, após revisão, em 25/6/2018 |
|
Av. Paulista, 37 - 7° andar - Conj. 71 - CEP 01311-902 - São Paulo - SP - Brazil - Phone: (11) 3372-4544 - Fax: (11) 3372-4554