Radiologia Brasileira - Publicação Científica Oficial do Colégio Brasileiro de Radiologia
AMB - Associação Médica Brasileira CNA - Comissão Nacional de Acreditação
 Vol. 53 nº 6 - Nov. / Dez. of 2020
Vol. 53 nº 6 - Nov. / Dez. of 2020
|
ARTIGO DE REVISÃO
|
|
|
|
|
Autho(rs): Carlos Henrique de Sousa Rosas1,a; Ana Carolina de Ataíde Góes1,b; Laís Martinho Saltão1,c; Adriana Michiko da Silva Tanaka2,d; Elvira Ferreira Marques1,e; Almir Galvão Vieira Bitencourt1,f |
|
|
Descritores: Gestação; Lactação; Mama; Diagnóstico por imagem. |
|
|
Resumo: INTRODUÇÃO
Gravidez e lactação são estados biológicos que induzem mudanças notáveis nas glândulas mamárias em resposta a estímulos hormonais(1,2). Essas mudanças fisiológicas resultam, clinicamente, em aumento do volume, da firmeza e das nodulações das mamas, tornando o exame físico mais difícil(2,3). Dentro desse cenário, há um aumento da importância dos exames de imagem como forma diagnóstica complementar. Os métodos de imagem, por sua vez, também se deparam com dificuldades, uma vez que as alterações da imagem mamária nesses períodos podem simular a presença de algumas doenças, bem como tornar confusa a avaliação de outras pré-existentes(3). Sendo assim, as alterações ocorridas na mama durante esses estados fisiológicos tornam a avaliação clínica e radiológica dessas pacientes desafiadora(4). Este artigo faz uma revisão da utilização dos métodos imagem da mama durante a gravidez e lactação, analisando as alterações fisiológicas esperadas e as principais afecções mamárias encontradas nesses períodos. ALTERAÇÕES FISIOLÓGICAS ESPERADAS NA GRAVIDEZ E LACTAÇÃO As alterações mamárias durante a gravidez e a lactação refletem os níveis séricos de estrogênio, progesterona e prolactina(3–6). Sob a influência de níveis crescentes de estrogênio, com início no primeiro trimestre da gestação, há crescimento e proliferação ductal e, em menor grau, crescimento alvéolo-lobular(3). Ocorre expansão do tecido glandular e involução do tecido adiposo(2), além de proliferação vascular e aumento do fluxo sanguíneo(5). Durante o segundo e terceiro trimestres de gestação, a progesterona é responsável por hiperplasia lobular e involução do estroma fibrogorduroso(3,5). Após o parto, ocorre diminuição do estrogênio e progesterona, desativando o bloqueio da prolactina que, associado a liberação da ocitocina, determina a conversão para um estado secretor(7). Essa conversão do tecido mamário, de um estado proliferativo durante a gravidez para um estado secretor durante a lactação, denomina-se lactogênese(3). Na lactação, o hormônio prolactina domina e é responsável pela produção de leite(5). MÉTODOS DE IMAGEM Ultrassonografia A ultrassonografia é o método de escolha para avaliação inicial das mamas na gravidez e lactação, podendo ser realizada a qualquer momento, uma vez que não tem radiação ionizante ou contraste e apresenta sensibilidade de 87–100% para diagnóstico de lesões mamárias(1,3–5). Apesar de não haver consenso na literatura, alguns autores referem que a ultrassonografia deve ser indicada para pacientes gestantes ou lactantes que apresentarem nódulos palpáveis por mais de duas semanas(8,9), além de descarga papilar sanguinolenta espontânea associada(10). Na ultrassonografia durante a gravidez, o parênquima mamário apresenta aumento do componente fibroglandular não gorduroso, com hipoecogenicidade difusa no primeiro trimestre. No segundo e terceiro trimestres as alterações fisiológicas com proliferação lobular podem provocar aumento da ecogenicidade do parênquima fibroglandular. No final do período gestacional há aparecimento de estruturas tubulares hipoecoicas que correspondem a ductos com colostro. Durante a lactação os ductos ficam hiperecogênicos por conterem leite (componente adiposo), predominando hiperecogenicidade difusa, com sistema ductal proeminente e vascularização aumentada(1,5). Mamografia A mamografia tem papel limitado durante a gravidez e lactação, em razão do aumento difuso da densidade do parênquima mamário (Figura 1)(1,4), o que causa uma redução da sua sensibilidade. Além disso, a mamografia envolve o uso de radiação ionizante, embora a dose de radiação recebida pelo feto, com a proteção abdominal, seja estimada em 0,004 Gy e considerada segura, pois é necessária uma dose mínima de 0,05 Gy para o surgimento de malformações fetais(1,4). Assim, devido ao risco da radiação ionizante para o feto durante a organogênese, no primeiro trimestre da gravidez, a mamografia deve ser evitada(3,6). 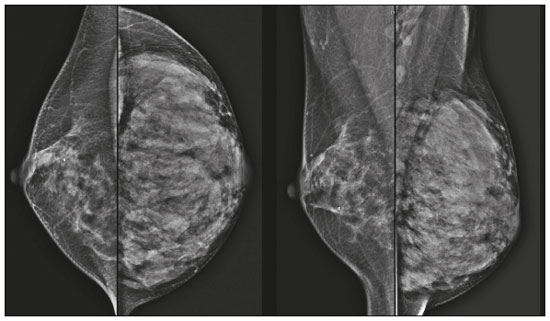 Figura 1. Mamografia bilateral nas incidências craniocaudal e mediolateral-oblíqua em paciente lactante preferencial em uma das mamas (esquerda), notando-se assimetria entre as mamas, com aumento do volume e densidade na mama esquerda em detrimento da contralateral. No segundo e terceiro trimestres, a mamografia pode ser realizada em casos selecionados, devendo-se obter somente as incidências necessárias e oferecer proteção abdominal com avental de chumbo às pacientes(5). Por exemplo, a mamografia pode ser considerada em pacientes com queixa clínica quando a ultrassonografia for negativa ou revelar resultados indeterminados, suspeitos ou ausentes, em lesões suspeitas de conter gordura ou, ainda, se a biópsia de uma lesão sólida revelar malignidade(4,5). Na paciente lactante, a mamografia deve ser realizada após mamada ou ordenha, situações em que a densidade da mama diminui(1,4,5). Ressonância magnética A ressonância magnética (RM) das mamas não deve ser realizada durante a gestação. No primeiro trimestre, a RM deve ser evitada, pelo risco teórico de influência do campo magnético na organogênese fetal. No segundo e terceiro trimestres, o aumento do volume abdominal da gestante dificulta o posicionamento do exame em decúbito ventral com as mamas pendentes. Além disso, o uso do contraste paramagnético, fundamental para avaliação do parênquima mamário, deve ser indicado apenas em situações em que a relação risco-benefício é clara na avaliação das pacientes gestantes, uma vez que o gadolínio intravenoso atravessa a placenta(3,4). Apesar de não haver comprovação de danos ao feto pelo gadolínio, já foi demonstrado retardo do crescimento fetal em estudos com animais quando administrado em doses elevadas(5). A RM pode ser realizada no período da lactação, no entanto, tem papel limitado pela vascularização marcadamente aumentada do parênquima mamário, que pode reduzir a sensibilidade do método(3,5). Não há necessidade de suspender a amamentação após o uso de contraste gadolínio, pois a dose absorvida pelo recém-nascido é 0,0004% da dose injetada, representando menos de um centésimo da dose permitida no lactente (200 µmol/kg)(11). Porém, se a paciente desejar evitar qualquer ingestão de gadolínio pelo lactente, o leite materno deve ser bombeado e descartado por 24 horas após a administração do gadolínio(2). Biópsias percutâneas Tanto a punção aspirativa por agulha fina (PAAF) como a biópsia por fragmentos com agulha grossa podem ser realizadas normalmente durante a gestação, preferencialmente guiadas por ultrassonografia. A PAAF com avaliação citológica é um método rápido e acessível, útil para avaliação de cistos palpáveis dolorosos, além de coleções no caso de suspeita de abscessos mamários(12). Na avaliação de nódulos sólidos tem papel secundário, devendo-se considerar a experiência do radiologista e do citopatologista, podendo haver falso-positivos devidos a achados relacionados ao estado gravídico-lactacional como hiperplasia lactacional e hipercromia(1,12). A biópsia por fragmentos (core biopsy) também é um método seguro, amplamente disponível e com boa relação custo-efetividade, sendo considerado o padrão ouro na avaliação tecidual de lesões mamárias na gravidez e lactação(1). Tem como vantagens em relação à PAAF a possibilidade de definição de subtipos histológicos e imuno-histoquímicos e do grau nuclear das lesões(9). As biópsias são geralmente guiadas por ultrassonografia, porém, nos casos de achados mamográficos suspeitos como microcalcificações, podem ser guiadas por estereotaxia(12) em gestações iniciais(9). O risco de complicações como hemorragias, fístulas lácteas e infecções, inerentes ao procedimento, é teoricamente aumentado nas mulheres gestantes e lactantes, em razão do aumento da vascularização do parênquima mamário, produção de leite, dilatação ductal e traumas mamários inerentes à amamentação(1). Medidas podem ser utilizadas para reduzir o número de complicações, como a suspensão da amamentação anteriormente à biópsia, uso de agulhas com calibre menor (especialmente para evitar fístulas lácteas e galactoceles), compressão e assepsia rigorosas(9). ALTERAÇÕES BENIGNAS MAIS COMUNS Oitenta por cento das pacientes que apresentam massa mamária palpável durante a gravidez e lactação terão diagnóstico de doença benigna(2), sendo algumas específicas, como adenoma da lactação e galactocele(3). Muitos tumores de mama diagnosticados durante a gravidez e lactação podem já existirem, mas se manifestam durante esse período decorrentes das mudanças hormonais e fisiológicas(1). Galactocele Galactocele é a massa benigna mais comum da lactante(2) e geralmente é vista após a cessação da amamentação(1), mas pode também ser vista durante a lactação e, menos comumente, no terceiro trimestre de gestação(2). Geralmente ocorre como resultado de um ducto distal obstruído, o qual provoca distensão dos segmentos proximais lobulares(3), apresentando-se clinicamente como massa palpável e indolor(2). Pode ocorrer em um ou em ambos os seios(5) e frequentemente pode apresentar complicações como infecção e necrose(6). A aparência ultrassonográfica varia dependendo da quantidade de gordura, proteína e água(3), bem como sua cronicidade(5). Tipicamente, é uma lesão cística (50%) e o aspecto mais característico é de cisto formando nível líquido-gordura ou líquido-líquido espesso. Outras formas menos comuns são sólido-cístico (37%) e sólido (13%). Quando sólido, costuma ser circunscrito e com reforço posterior(7), e em alguns casos pode se apresentar de forma irregular e margens não circunscritas(3). Em caso de inflamação, a paciente pode referir dor local e a lesão pode apresentar paredes espessadas e conteúdo heterogêneo(7). A mamografia e a RM podem ser necessárias quando houver suspeita de outras doenças como abscesso e câncer, pois a demonstração de gordura ou de nível líquido-gordura nesses métodos pode confirmar o diagnóstico (Figuras 2 e 3)(2,3).  Figura 2. Paciente lactante de 29 anos, com queixa de massa palpável na mama direita. Ultrassonografia (A) demonstrou cisto complexo com conteúdo hipoecogênico e paredes espessadas, sem fluxo significativo no estudo Doppler. Mamografia (B) demonstrou nódulo com calcificações periféricas e áreas de densidade de gordura no seu interior. Estudo por punção confirmou o diagnóstico de galactocele. 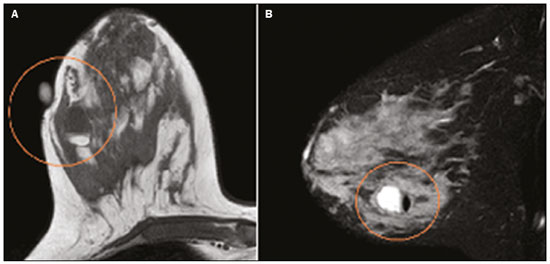 Figura 3. Imagens de RM ponderadas em T1 (A) e T2 (B) mostrando cisto com finos septos e conteúdo heterogêneo, apresentando nível líquido-gordura, compatível com conteúdo gorduroso/galactocele. A maioria dos casos regride espontaneamente(2). A punção pode ser realizada como diagnóstico ou terapia nos casos em que a galactocele se apresenta como massa complexa e que seja necessário diagnóstico diferencial com outras afecções mamárias, ou, ainda, que seja grande e sintomática(5). Adenoma lactacional O adenoma lactacional é um tumor benigno relacionado às alterações fisiológicas do ciclo gravídico-lactacional, notadamente durante o terceiro trimestre da gravidez e a lactação(2). A exata etiologia desses tumores ainda é desconhecida e se discute a possibilidade de o adenoma ser uma lesão nova ou uma variante de uma lesão preexistente sob influência hormonal, como o fibroadenoma e o adenoma tubular(1). Histologicamente, consiste de elementos epiteliais com características secretoras, semelhantes ao parênquima mamário adjacente da lactante(2). O principal diagnóstico diferencial do adenoma lactacional é com o fibroadenoma, já que ambos podem se apresentar clinicamente como nódulo palpável, móvel e indolor, de aspecto ultrassonográfico benigno, ressaltando-se que o adenoma regride espontaneamente após a gravidez ou cessação da lactação(1,3,13). Ambos podem ser indistiguíveis aos exames de imagem, com apresentação típica ultrassonográfica de lesão oval, circunscrita, hipo ou isoecogênica, com o maior eixo paralelo à pele, apresentando reforço acústico posterior e septações ecogênicas no seu interior (Figura 4). No estudo Doppler, o adenoma lactacional costuma ser mais vascularizado quando comparado ao fibroadenoma(5). A presença de áreas radioluzentes na mamografia e hiperecogênicas na ultrassonografia é útil para o diagnóstico do adenoma e representa componente gorduroso do leite secundário a hiperplasia lactacional(1). Em 5% dos casos os adenomas podem enfartar, diante do rápido crescimento e relativa redução do suprimento sanguíneo, apresentando-se como uma massa dolorosa. Nesses casos podem mimetizar uma lesão maligna no estudo ultrassonográfico, com aspecto irregular, sólido-cístico, com sombra acústica posterior(1,3,5). A RM também mostra nódulo de contornos regulares, com variação entre alto sinal e sinal intermediário nas sequências ponderadas em T2 e realce homogêneo nas fases pós-contraste(7). 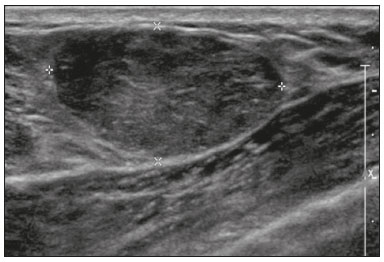 Figura 4. Ultrassonografia de mama direita mostrando nódulo oval, hipoecogênico, circunscrito, sem efeitos acústicos posteriores e com maior eixo paralelo à pele. Biópsia por agulha grossa confirmou o diagnóstico de adenoma lactacional. Fibroadenoma Fibroadenoma é o tumor benigno mais comum na gestação e lactação e costuma responder aos estímulos hormonais do período. A maioria desses tumores é preexistente à gestação e sua identificação é facilitada pelo aumento dimensional decorrente da elevação dos níveis hormonais, voltando a regredir após a interrupção da amamentação(1,3,5). Os achados típicos de imagem assemelham-se aos de mulheres não grávidas não lactantes, podendo apresentar discreto aumento da sua ecogenicidade na ultrassonografia. Entretanto, durante a gestação, podem apresentar aspecto atípico decorrente de hiperplasia secretória e alterações lactacionais, com acúmulo interno de leite simulando a galactocele (Figura 5). Nesses casos demonstram, no estudo ultrassonográfico, ecogenicidade heterogênea, com áreas císticas, às vezes formando níveis, e dilatação ductal(5). Apesar de incomum, quando apresentam crescimento rápido, podem evoluir com áreas de infarto, sendo suspeitados clinicamente com o surgimento de dor em sítio de fibroadenoma preexistente(1). De forma semelhante ao adenoma lactacional, a presença de achados atípicos nos exames de imagem pode necessitar de investigação anatomopatológica para confirmar o diagnóstico(3). 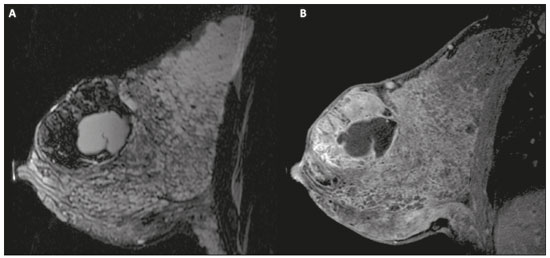 Figura 5. Paciente de 34 anos, lactante, com queixa de crescimento de nódulo na mama esquerda. Imagens de RM ponderadas em T2 (A) e T1 pós-contraste (B) mostrando massa sólido-cística complexa nos quadrantes superiores da mama esquerda, na área de nódulo com biópsia prévia compatível com fibroadenoma. Nova biópsia percutânea confirmou o diagnóstico de fibroadenoma com alterações lactacionais. Embora apresentem aspectos de imagem provavelmente benignos (BI-RADS 3), o manejo dos fibroadenomas na gestação e lactação pode ser dividido em dois grupos de pacientes. As pacientes com nódulos diagnosticados durante a gestação devem ser avaliadas individualmente, considerando fatores de risco e história familiar, em que nódulos com características provavelmente benignas menores que 10 mm podem ser acompanhados e os com características suspeitas ou maiores que 30 mm devem ser biopsiados, enquanto os com dimensões entre 10–30 mm deverão ter conduta individualizada. Nos casos das pacientes com nódulos provavelmente benignos diagnosticados anteriormente à gestação, estes nódulos devem ser monitorados com frequência semelhante e, caso mantenham estabilidade nos aspectos morfológicos e crescimento de até 20% das dimensões, a conduta deve ser expectante, ao passo que nos casos em que haja aumento dimensional superior a 20%, mudança morfológica ou dúvida diagnóstica, a biópsia percutânea deve ser realizada(12). Outros achados que sugerem realização de biópsia percutânea são fibroadenomas gigantes (superiores a 50 mm) e achados clínicos suspeitos como espessamento ou ulceração cutânea e inversão de papila(14). Mastite puerperal e abscesso Mastite é um processo inflamatório da mama, provocado ou não por infecção, e o abscesso é geralmente a sua complicação, definida como uma coleção purulenta. A mastite raramente ocorre na gravidez, porém, é relativamente comum durante a lactação, ocorrendo em aproximadamente 10% das lactantes, em geral nas primeiras seis semanas do pós-parto(15). A sua fisiopatologia é explicada pela transmissão bacteriana originada do nariz e da boca do lactente para a mãe pelas fissuras mamárias. Outros fatores de risco incluem estase do leite, por este ser um excelente meio de cultura bacteriana, obstrução de ductos e ingurgitamento mamário(4). Os principais agentes etiológicos são o Staphylococcus aureus e o Streptococcus(15), dos quais o primeiro determina um processo mais localizado e invasivo e o segundo tende a se manifestar como mastite difusa evoluindo com abscessos apenas nas fases mais avançadas(1). Aproximadamente 5% a 11% das mastites puerperais evoluem para abscesso(4). As pacientes geralmente apresentam sinais flogísticos (dor, edema e eritema) nas mamas, às vezes associados a sintomas sistêmicos, como febre, dores no corpo e fadiga(15). Seu diagnóstico é clínico, reservando-se os exames de imagem para os casos complicados em que há suspeita de abscesso ou nos casos refratários ao tratamento(2). O diagnóstico de abscesso pode ser dificultado na fase pré-supurativa, sendo confundido com uma lesão maligna na fase supurativa(16). A ultrassonografia é o método de eleição para a investigação de mastite complicada com abscesso, o qual se caracteriza tipicamente por formação anecoica ou hipoecoica, com septações finas ou débris no seu interior, paredes espessadas e contornos não circunscritos, determinando reforço acústico posterior(1). No estudo Doppler apresenta vascularização periférica, não sendo detectado fluxo dentro da coleção(4). A forma subaguda da mastite pode apresentar sinais de periductite, caracterizados por coleções fluidas ao longo dos ductos subareolares(1). A mamografia não tem papel bem estabelecido nos casos de mastite e abscesso, porém, quando realizada, demonstra espessamento da pele, podendo estar associado a assimetria global ou massa mamária(5). O abscesso pode se apresentar de forma atípica e simular uma massa sólido-cística, ou de aspecto puramente sólido, com hipervascularização adjacente no estudo Doppler, determinando retardo no diagnóstico adequado(5). O manejo do abscesso classicamente inclui a aspiração guiada por ultrassonografia, seja com intenção terapêutica, reduzindo a duração da doença e promovendo o rápido alívio da dor, seja para a elucidação diagnóstica nos casos atípicos(15). Mastite granulomatosa idiopática É uma rara condição inflamatória e crônica da mama(17), encontrada em mulheres em idade fértil, comumente associada a pacientes no ciclo gravídico-lactacional, geralmente nos primeiros seis anos após a gestação(18,19). A hipótese autoimune tem sido aventada, bem como a relação com hiperprolactinemia(19), porém, a causa definitiva permanece incerta(17). O achado clínico mais comum é de massa palpável com relativa preservação da região retroareolar, podendo simular clinicamente o carcinoma mamário inflamatório. Outros achados incluem nódulos difusos e fístulas cutâneas. Linfadenopatia reacional pode estar presente em até 15% dos casos(17). As manifestações clinicorradiológicas são variáveis e inespecíficas, determinando um desafio diagnóstico para esta entidade(20). A investigação por estudo anatomopatológico é determinante, o qual demonstra granulomas não caseosos lobulares(18), devendo-se excluir outras doenças como tuberculose, infecções fúngicas, sarcoidose e granulomatose de Wegener(3). Apesar de não conclusiva, a ultrassonografia é o método de escolha tanto para investigação inicial quanto para auxiliar na punção diagnóstica, podendo demonstrar nódulo ou massa hipoecoica(6,21), única ou múltipla, heterogênea, com margens circunscritas, de aspecto tubular. Abscesso difuso e formação de fístulas também podem ser encontrados(4). Os achados mamográficos são também variáveis, podendo ser mascarados pela alta densidade da mama, sendo a assimetria focal ou global o achado mais comum(22). De forma correspondente, a assimetria focal ou difusa de intensidade de sinal é a alteração mais frequente na RM, com a vantagem de avaliar a vascularização com base no uso do contraste dinâmico, bem como caracterizar melhor a extensão do processo inflamatório(20). CÂNCER DE MAMA RELACIONADO À GESTAÇÃO O câncer de mama relacionado à gestação compreende os descobertos durante a gravidez e até um ano após o parto(3,9). A incidência pode variar de 1:3000 a 1:10000 gestações(9). O câncer de mama relacionado à gestação apresenta comportamento biológico usualmente mais agressivo e receptor negativo para estrogênio e progesterona e positivo para receptores tipo 2 do fator de crescimento epidérmico humano(3). O diagnóstico é comumente retardado em razão das alterações fisiológicas mamárias durante a gravidez, levando às vezes a subvalorização de sinais e sintomas referidos(23) e dificuldade na interpretação dos exames de imagem. Clinicamente, apresentam-se como massas palpáveis, e a ultrassonografia permanece como o melhor método para avaliação dessas lesões, permitindo diferenciação entre lesões sólidas e císticas(4). Na ultrassonografia apresentam-se comumente como nódulos de forma irregular e contornos não circunscritos, predominantemente hipoecogênicos ou de ecogenicidade mista (Figura 6)(9). Pacientes com lesões suspeitas devem ter avaliação complementar por mamografia após o primeiro trimestre de gestação(9). Os achados de imagem, nesses casos, são semelhantes aos encontrados em mulheres não grávidas não lactantes(4). 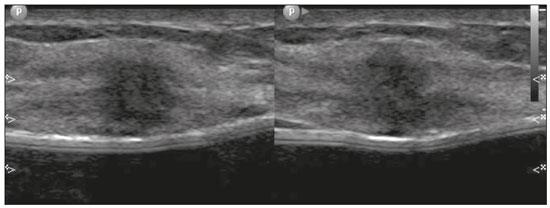 Figura 6. Paciente de 33 anos com 27 semanas de gestação apresentando nódulo palpável na mama esquerda. Ultrassonografia demonstrando nódulo hipoecogênico de contornos irregular e margens não circunscritas. Biópsia percutânea confirmou o diagnóstico de carcinoma ductal invasivo. Os estudos por RM mamária não são realizados na gravidez, uma vez que há passagem pela barreira placentária dos quelatos de gadolínio, e não existem estudos suficientes sobre seus efeitos no feto(5). No período da amamentação, o uso de contraste de gadolínio é permitido pelo American College of Radiology(24), sem necessidade de suspensão da amamentação após sua injeção. Apesar da segurança apontada na injeção do contraste de gadolínio durante a amamentação, ainda existe discordância entre os autores quanto à sua utilização. Em estudo desenvolvido por Myers et al.(25), a realização da RM pré-operatória caracterizou área de doença maior que a visualizada na ultrassonografia e mamografia em 25% das pacientes com câncer de mama relacionado à gestação, modificando o planejamento cirúrgico em 23% das pacientes avaliadas. Os achados na RM são semelhantes aos encontrados em pacientes não gestantes, destacando-se massas com realce homogêneo ou heterogêneo, massa com realce periférico, realce não massa com distribuição focal, segmentar ou difusa (Figura 7)(26). 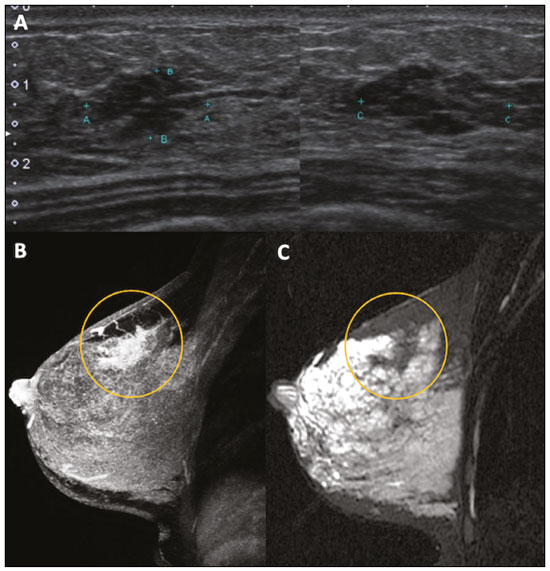 Figura 7. Paciente de 38 anos no sexto mês de puerpério. Ultrassonografia (A) mostrando nódulo irregular de contornos microlobulados, hipoecogênico. Imagens de RM ponderadas em T1 pós-contraste (B) e T2 (C) identificando área de realce não massa (B) no quadrante superolateral da mama direita, com baixo sinal em T2 (C), ao contrário do restante do parênquima mamário, que apresenta sinal intermediário a alto decorrente do estado lactacional. CONCLUSÃO O estado gravídico puerperal, bem como o período de lactação, corresponde a uma época de grande variação hormonal no corpo feminino, determinando importantes alterações estruturais e secretórias nas mamas. É importante o conhecimento dessas mudanças por médicos radiologistas que atuam na área de saúde da mulher, especialmente em imagem da mama, para que variações fisiológicas não sejam interpretadas equivocadamente, bem como as principais entidades benignas e malignas relacionadas a esse período sejam diagnosticadas com eficiência e precisão. REFERÊNCIAS 1. Sabate JM, Clotet M, Torrubia S, et al. Radiologic evaluation of breast disorders related to pregnancy and lactation. Radiographics. 2007;27 Suppl 1:S101–24. 2. Vashi R, Hooley R, Butler R, et al. Breast imaging of the pregnant and lactating patient: physiologic changes and common benign entities. AJR Am J Roentgenol. 2013;200:329–36. 3. Holanda AAR, Gonçalves AKS, Medeiros RD, et al. Ultrasound findings of the physiological changes and most common breast diseases during pregnancy and lactation. Radiol Bras. 2016;49:389–96. 4. Joshi S, Dialani V, Marotti J, et al. Breast disease in the pregnant and lactating patient: radiological-pathological correlation. Insights Imaging. 2013;4:527–38. 5. Parker S, Saettele M, Morgan M, et al. Spectrum of pregnancy- and lactation-related benign breast findings. Curr Probl Diagn Radiol. 2017;46:432–40. 6. Yu JH, Kim MJ, Cho H, et al. Breast diseases during pregnancy and lactation. Obstet Gynecol Sci. 2013;56:143–59. 7. Tanaka A. Gestação e lactação. In: Bitencourt AGV, Marques EF, editores. Atlas de diagnóstico por imagem da mama: correlação entre os diferentes métodos de imagem. 1ª ed. Rio de Janeiro, RJ: Elsevier; 2018. p. 355–66. 8. Krishna I, Lindsay M. Breast cancer in pregnancy. Obstet Gynecol Clin North Am. 2013;40:559–71. 9. Kakoulidis I, Skagias L, Politi E. Pregnancy associated breast cancer (PABC): aspects in diagnosis. Breast Dis. 2015;35:157–66. 10. Tirada N, Dreizin D, Khati NJ, et al. Imaging pregnant and lactating patients. Radiographics. 2015;35:1751–65. 11. Kubik-Huch RA, Gottstein-Aalame NM, Frenzel T, et al. Gadopentetate dimeglumine excretion into human breast milk during lactation. Radiology. 2020;216:555–8. 12. Langer A, Mohallem M, Berment H, et al. Breast lumps in pregnant women. Diagn Interv Imaging. 2015;96:1077–87. 13. Sumkin JH, Perrone AM, Harris KM, et al. Lactating adenoma: US features and literature review. Radiology. 1998;206:271–4. 14. Karaguelle E, Turk E, Erinanc OH, et al. Giant fibroadenoma growing rapidly during pregnancy. Iran Red Crescent Med J. 2014;16:e9531. 15. Spencer JP. Management of mastitis in breastfeeding women. Am Fam Physician. 2008;78:727–31. 16. Boisserie-Lacroix M, Dos Santos E, Belléannée G, et al. La femme enceinte : difficultés diagnostiques. Imagerie de la Femme. 2004;14: 145–52. 17. Han BK, Choe YH, Park JM, et al. Granulomatous mastitis: mammographic and sonographic appearances. AJR Am J Roentgenol. 1999;173:317–20. 18. Stefanon CC, Gonçalves AF, Lima R, et al. Mastite granulomatosa idiopática : aspectos clínicos, radiológicos e ultra-sonográficos. Radiol Bras. 2005;38:225–30. 19. Nikolaev A, Blake CN, Carlson DL. Association between hyperprolactinemia and granulomatous mastitis. Breast J. 2016;22:224–31. 20. Pluguez-Turull CW, Nanyes JE, Quintero CJ, et al. Idiopathic granulomatous mastitis: manifestations at multimodality imaging and pitfalls. Radiographics. 2018;38:330–56. 21. Canoy JM, Mitchell GS, Unold D, et al. A radiologic review of common breast disorders in pregnancy and the perinatal period. Semin Ultrasound CT MR. 2012;33:78–85. 22. Memis A, Bilgen I, Ustun EE, et al. Granulomatous mastitis: imaging findings with histopathologic correlation. Clin Radiol. 2002; 57:1001–6. 23. Doyle S, Messiou C, Rutherford JM, et al. Cancer presenting during pregnancy: radiological perspectives. Clin Radiol. 2009;64:857–71. 24. ACR Committee on Drugs and Contrast Media. Administration of contrast media to women who are breast-feeding. In: ACR Manual on Contrast Media. Reston, VA: American College of Radiology; 2020. p. 101–2. 25. Myers KS, Green LA, Lebron L, et al. Imaging appearance and clinical impact of preoperative breast MRI in pregnancy-associated breast cancer. AJR Am J Roentgenol. 2017;209:W177–W183. 26. Ayyappan AP, Kulkarni S, Crystal P. Pregnancy-associated breast cancer: spectrum of imaging appearances. Br J Radiol. 2010;83:529–34. 1. A.C.Camargo Cancer Center, Departamento de Imagem, São Paulo, SP, Brasil 2. Amaral Costa Medicina Diagnóstica, Belém, PA, Brasil a. https://orcid.org/0000-0002-0975-7240 b. https://orcid.org/0000-0003-3226-7503 c. https://orcid.org/0000-0002-0456-0545 d. https://orcid.org/0000-0002-9063-7966 e. https://orcid.org/0000-0001-7572-9371 f. https://orcid.org/0000-0003-0192-9885 Correspondência: Dr. Almir Galvão Vieira Bitencourt A.C.Camargo Cancer Center, Departamento de Imagem Rua Professor Antônio Prudente, 211, Liberdade São Paulo, SP, Brasil, 01509-010 E-mail: almir.bitencourt@accamargo.org.br Recebido para publicação em 3/6/2019 Aceito, após revisão, em 6/8/2019 |
|
Av. Paulista, 37 - 7° andar - Conj. 71 - CEP 01311-902 - São Paulo - SP - Brazil - Phone: (11) 3372-4544 - Fax: (11) 3372-4554