Radiologia Brasileira - Publicação Científica Oficial do Colégio Brasileiro de Radiologia
AMB - Associação Médica Brasileira CNA - Comissão Nacional de Acreditação
 Vol. 41 nº 2 - Mar. / Abr. of 2008
Vol. 41 nº 2 - Mar. / Abr. of 2008
|
ARTIGO DE REVISÃO
|
|
|
|
|
Autho(rs): Dario Ariel Tiferes, Giuseppe D'Ippolito |
|
|
Descritores: Fígado, Neoplasia, Imagem por ressonância magnética, Ultra-sonografia, Tomografia computadorizada |
|
|
Resumo:
INTRODUÇÃO Uma grande variedade de tumores benignos e malignos ocorre no fígado. Embora a caracterização de lesões hepáticas focais possa ser um desafio para o radiologista, a maioria das lesões se apresenta com características de imagem que permitem o diagnóstico. O objetivo deste trabalho é rever o aspecto de imagem dos tumores hepáticos benignos e malignos mais comumente encontrados no fígado em adultos. Neste texto descreveremos as principais características do hemangioma, da hiperplasia nodular focal, do adenoma, do carcinoma hepatocelular, do colangiocarcinoma intra–hepático e das metástases hepáticas observadas em exames de ultra–sonografia (US), tomografia computadorizada (TC) e ressonância magnética (RM).
HEMANGIOMA O hemangioma é o tumor hepático benigno mais comum, com incidência, em estudos de autópsias, de 0,4% a 20%(1,2), representando achado incidental muito freqüente em exames de imagem, particularmente na US. Na maioria dos casos são pequenos (até 3,0 cm) e podem ser múltiplos em até 50% dos pacientes(3). Microscopicamente, consistem de espaços vasculares de tamanhos variados, revestidos por uma única camada de células endoteliais e separados por septos de tecido conjuntivo(4). O aspecto de nódulo hiperecogênico, homogêneo e bem delimitado na US é altamente indicativo de hemangioma(3) (Figura 1). Os achados na TC incluem a presença de lesão hipoatenuante na fase não–contrastada. Após a administração intravenosa de meio de contraste iodado, o padrão característico de realce inclui impregnação globular periférica nas fases arterial e portal, preenchimento centrípeto progressivo e persistência do realce na fase de equilíbrio(3,5,6) (Figura 2). A não–opacificação total da lesão não impede o diagnóstico de hemangioma. Freqüentemente, lesões volumosas persistem com áreas centrais que não se opacificam e podem representar regiões de fibrose, hemorragia antiga e alterações císticas(7,8).
Hemangiomas pequenos (de até 1,5 cm) freqüentemente apresentam realce precoce e completo pelo meio de contraste. Este padrão de realce é decorrente do pequeno tamanho dos espaços vasculares, aumentando assim a velocidade do fluxo sanguíneo (e do meio de contraste) no seu interior. A persistência de impregnação na fase de equilíbrio ajuda a diferenciar o hemangioma de outras lesões hipervasculares, como a hiperplasia nodular focal e alguns tipos de metástases que apresentam clareamento mais rápido(7). Na RM os hemangiomas são caracterizados por lesões bem delimitadas com acentuado hipersinal em T2, persistente, com tempos de eco altos (ao redor de 180 ms)(2,5). O padrão de impregnação pelo gadolínio é semelhante à impregnação pelo meio de contraste iodado da TC (Figura 3). Utilizando seqüências ponderadas em T2 e o estudo dinâmico com meio de contraste paramagnético intravascular, a sensibilidade e a especificidade da RM no diagnóstico de hemangioma atingem 98%(5).
A cintilografia com hemácias marcadas, embora apresente alta especificidade para o diagnóstico de hemangioma(9), não é utilizada de maneira rotineira pela baixa acurácia no diagnóstico de lesões pequenas e/ou múltiplas. Os hemangiomas podem apresentar padrões ultra–sonográficos atípicos, porém ainda bastante sugestivos. Por exemplo, podem apresentar halo ecogênico e centro hipoecogênico(10) (Figura 1). Hemangiomas gigantes (geralmente acima de 6 cm ou 10 cm) freqüentemente exibem ecotextura heterogênea, com áreas hiper e hipoecogênicas internas. Ainda, no fígado esteatótico, o hemangioma freqüentemente se apresenta como nódulo hipoecogênico em função da elevada ecogenicidade do parênquima hepático. A maioria dos hemangiomas com padrões atípicos na US apresenta padrões de impregnação típicos pelos meios de contraste intravenosos na TC e RM(7,8). Outros aspectos menos comuns de hemangiomas incluem lesões calcificadas, hialinizadas e císticas/multiloculares. Os hemangiomas também podem ser exofíticos ou pedunculados e não–infreqüentemente apresentam pequenas anastomoses arterioportais adjacentes que determinam distúrbios perfusionais transitórios no parênquima hepático vicinal observados nos estudos por TC e RM(7).
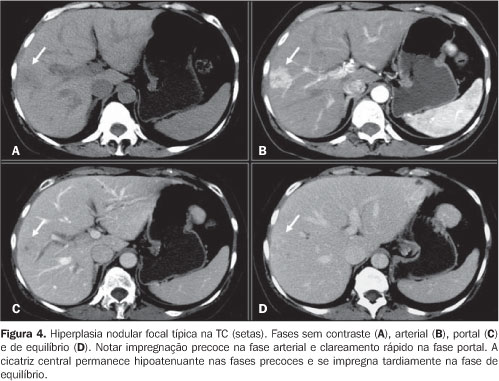
HIPERPLASIA NODULAR FOCAL Hiperplasia nodular focal (HNF) é definida como nódulo composto por hepatócitos de aparência normal e que ocorre em fígado com aspecto histológico normal. É o segundo tumor hepático benigno mais freqüente, com incidência descrita de 0,9%. Ocorre predominantemente no sexo feminino (8:1) e em pacientes jovens. Cerca de 20% dos pacientes têm lesões múltiplas e existe associação da ocorrência destes tumores com hemangiomas hepáticos(11). A HNF pode ser dividida em clássica (80%) e não–clássica (20%), segundo seus aspectos histológicos. A clássica apresenta três componentes: arquitetura nodular anormal, vasos malformados e proliferação de ductos biliares. A não–clássica contém dois dos três componentes, incluindo a proliferação ductal(11). A patogênese da HNF não é totalmente conhecida. Malformação vascular e/ou injúria vascular são sugeridas como possíveis mecanismos para seu desenvolvimento(12). A associação com esteróides é controversa. O tumor é geralmente assintomático e, nestes casos, não requer tratamento(13). É comumente um achado incidental em exames de imagem, especialmente após a incorporação e aprimoramento dos estudos dinâmicos com meios de contrastes intravenosos na TC e RM(14,15). Na US tem padrão inespecífico e é mal visualizada. Geralmente se apresenta como nódulo ligeiramente hipoecogênico ou hiperecogênico e sua caracterização definitiva com este método não é possível(15). A HNF clássica geralmente é caracterizada com grande eficácia pela TC e RM. Atualmente, a TC helicoidal e especialmente a TC com múltiplas fileiras de detectores (multislice) permitem estudo hepático multifásico (contrastação hepática arterial, portal e de equilíbrio), indispensável para a avaliação da vascularização do tumor e sua correta caracterização. Os aspectos típicos da HNF na TC incluem lesão lobulada e bem delimitada, iso ou levemente hipoatenuante na fase pré–contraste, e com importante realce homogêneo na fase arterial do contraste, com clareamento (wash–out) rápido nas fases portal e de equilíbrio. Comumente é vista pequena área central estrelada que tende a se impregnar nas fases tardias (cicatriz central), composta por vasos mal formados(14,15) (Figura 4).
Na RM, a HNF clássica apresenta–se como lesão ligeiramente hipointensa em T1 e com discreta hiperintensidade em T2. Em 85% das lesões é possível a identificação da cicatriz central, que se apresenta com maior sinal do que o restante da lesão nas imagens ponderadas em T2. O padrão de realce pelo meio de contraste intravenoso da HNF é semelhante ao descrito na TC(14). Quando estas características são presentes, a especificidade diagnóstica atinge 98%(14) (Figura 5).
HNFs atípicas podem se apresentar como lesões grandes, heterogêneas e com múltiplas localizações. O tumor pode apresentar menor grau de realce pelo meio de contraste, ausência de realce da cicatriz central e realce de pseudocápsula nas fases tardias. Calcificações puntiformes centrais podem ser excepcionalmente observadas(15). Nestas situações, a diferenciação da HNF com outras lesões benignas (adenomas) e malignas (hepatocarcinoma, carcinoma fibrolamelar e metástases hipervascularizadas) pode ser extremamente dificultada, sendo necessário estudo histológico.
ADENOMA O adenoma hepatocelular é neoplasia benigna rara, usualmente encontrada em mulheres com antecedente de uso de contraceptivos orais(16). Embora o mecanismo patogênico não seja totalmente compreendido, a utilização de medicações estrogênicas ou androgênicas, especialmente por longos períodos, aumenta significantemente a incidência do tumor(16). Pacientes com doenças de depósito de glicogênio também apresentam risco aumentado para desenvolver adenomas(17). Os adenomas têm sido detectados com maior freqüência como achados incidentais em pacientes que realizam TC ou RM contrastadas multifásicas. Ocorrem de maneira solitária em cerca de 70% dos casos(18,19). Os pacientes costumam ser assintomáticos e os testes laboratoriais de função hepática, bem como os níveis de alfafetoproteína, são normais. Adenomas muito volumosos podem apresentar sangramento intratumoral e ruptura, causando dor abdominal e hipotensão(20). Histologicamente, os adenomas consistem de grandes cordões celulares que lembram hepatócitos normais, separados por sinusóides dilatados que possuem perfusão arterial. Não apresentam suprimento venoso portal, bem como ductos biliares(21). As células do adenoma possuem grande quantidade de glicogênio e lipídios, estes últimos raramente presentes sob a forma macroscópica(19). Muito raramente, esses tumores podem apresentar degeneração maligna para carcinoma hepatocelular, mesmo tendo permanecido estáveis por longos períodos. O aumento significativo das dimensões tumorais e dos níveis séricos de alfafetoproteína favorecem o diagnóstico de transformação maligna(22,23). O termo adenomatose hepática é aplicado em casos de múltiplos adenomas (mais do que dez), encontrados em pacientes sem fatores de risco conhecidos e, possivelmente, representa uma entidade distinta(24). Apesar de apresentar características histológicas semelhantes aos adenomas encontrados isoladamente, acredita–se que tenha maior potencial de crescimento, hemorragia e, eventualmente, transformação maligna(21). O adenoma pode ser detectado na US, mas normalmente não apresenta padrão ecográfico característico, e complementações com TC ou RM são usualmente necessárias para melhor avaliação da lesão(23). A característica que favorece o diagnóstico de adenoma na TC contrastada multifásica inclui a presença de lesão única (ou eventualmente múltiplas), bem delimitada e às vezes encapsulada. A presença de gordura ou focos hemorrágicos intralesionais é bastante típica. A lesão tende a se mostrar isoatenuante ao parênquima hepático na fase pré–contraste, com realce homogêneo na fase arterial, tendendo a tornar–se novamente isoatenuante ao parênquima hepático nas fases portal e de equilíbrio(23). Na RM as características de imagem que sugerem adenoma incluem hipersinal nas imagens ponderadas em T1 e em T2, sendo mais discreto nas últimas. A queda do sinal da lesão em seqüências gradiente–eco "fora de fase" indica a presença de gordura intralesional e é um dado que favorece o diagnóstico de adenoma. O padrão de realce pelo meio de contraste paramagnético é similar ao visto na TC(18,25) (Figura 6). Adenomas muito heterogêneos e com aspectos atípicos podem necessitar de estudos adicionais (RM com meio de contraste hepatoespecífico) ou mesmo de biópsia para excluir a possibilidade de malignidade. Os diagnósticos diferenciais dos adenomas incluem outras lesões hipervasculares que podem ocorrer em adultos jovens sem hepatopatia associada, como HNF, hepatocarcinoma fibrolamelar e metástases(23). O prognóstico dos adenomas não é bem estabelecido. Muitos podem permanecer estáveis por longos intervalos de tempo ou mesmo reduzir de tamanho com a descontinuidade da medicação estrogênica. Episódios de hemorragia e transformação maligna, embora raros, permanecem os principais problemas clínicos. Alguns critérios utilizados para indicar ressecção cirúrgica de adenomas incluem lesões com grandes dimensões (acima de 5,0 cm de diâmetro) e a presença de sintomas relacionados a hemorragia intratumoral(20,23). Em pacientes com número muito grande de lesões (adenomatose), o transplante hepático tem sido proposto, em razão do maior risco de malignidade desta entidade(18,20).
CARCINOMA HEPATOCELULAR O carcinoma hepatocelular (CHC) geralmente ocorre como complicação da cirrose hepática, especialmente naquela causado por vírus B e C(26,27), e sua prevalência em fígados cirróticos retirados em transplantes atinge 14%(28). Pacientes com cirrose hepática podem ser avaliados por US, TC e RM. Embora cada método tenha sua particularidade, a capacidade de detecção de uma lesão focal depende do contraste existente entre ela e o restante do parênquima, que pode ser influenciada pela presença de gordura, necrose e fibrose. As alterações hepáticas relacionadas a fibrose e regeneração nodular, associadas a alterações perfusionais decorrentes da hipertensão portal, comumente presentes neste pacientes, representam um desafio para a detecção e caracterização do CHC nos diversos métodos de imagem. Especialmente, a US apresenta importantes limitações para a avaliação de nódulos no fígado cirrótico. Devido ao maior risco de pacientes com cirrose desenvolverem CHC, ao se detectar qualquer nódulo sólido na US, preconiza–se prosseguir investigação com TC ou RM. É fundamental que tanto a TC como a RM sejam realizadas utilizando meios de contraste intravenosos e que seja possível realizar estudos multifásicos incluindo a fase arterial pós–contraste, imprescindível para a detecção e caracterização do CHC(27). Lesões nodulares no fígado cirrótico podem ser separadas em duas grandes categorias: nódulos regenerativos e displásicos ou neoplásicos(29). Nódulos regenerativos representam áreas de parênquima aumentadas como resposta a necrose e alterações circulatórias. Nódulos maiores que 3–5 mm são chamados de macrorregenerativos, mas raramente são maiores que 20 mm. Nódulos com dimensões maiores que 20 mm são geralmente displásicos. Os nódulos regenerativos podem conter ferro, e nestes casos são chamados de nódulos sideróticos(29). Apesar de histologicamente presentes em todos os fígados cirróticos, os nódulos regenerativos são vistos em uma minoria de pacientes na TC e em cerca de 50% dos casos na RM, sendo os nódulos sideróticos mais evidentes(27,30). Tais nódulos podem mostrar–se espontaneamente hiperatenuantes na TC não–contrastada, e normalmente, na RM, apresentam–se com hipossinal nas seqüências ponderadas em T2, devido à presença de ferro no seu interior. Nas seqüências ponderadas em T1 estes nódulos costumam apresentar discreto hipossinal ou isossinal ao parênquima hepático circunjacente e, menos freqüentemente, hipersinal. Após a injeção intravenosa de meios de contrastes, na TC e RM estes nódulos tipicamente não se realçam na fase arterial e se impregnam de maneira semelhante ao parênquima hepático na fase portal, não sendo mais identificados(27) (Figura 7).
Os nódulos displásicos apresentam características morfológicas que ocupam posição intermediária entre as características encontradas nos nódulos de regeneração e no CHC. Uma das classificações adotadas inclui nódulos displásicos de baixo grau, nódulos displásicos de alto grau, nódulos displásicos de alto grau com focos de CHC e o CHC propriamente dito. Os estudos histológicos mostram que, à medida que se avança na classificação, decrescem os números de tratos portais e acentuam–se as artérias no interior das lesões. Estes achados são determinantes na caracterização destas lesões(27,29). Apesar do uso de técnicas contrastadas multifásicas que incluem aquisições na fase arterial hepática, a TC e a RM ainda apresentam acurácia muito limitada na detecção do CHC. Estudos de correlação com fígados retirados de pacientes transplantados demonstraram sensibilidades da TC e RM na detecção da presença de CHC de 59–68% e 50%, respectivamente. Além disso, as sensibilidades na detecção do número total de lesões foram de 37–44% na TC e 50% na RM(28,31). Estes resultados são decorrentes da inclusão de muitos nódulos inferiores a 1,0 cm de diâmetro, notadamente difíceis de serem detectados pelos métodos de imagem. O CHC tem aparência variável na TC e RM. Apesar de o hipersinal nas imagens ponderadas em T2 da RM ser suspeito para CHC, o sinal das lesões é variável, podendo se apresentar com hipo, iso ou hipersinal em relação ao fígado adjacente nas imagens ponderadas em T1 e T2(27,31,32). Os pequenos CHCs, em sua maioria, são hipervascularizados, com realce preferencial na fase arterial do contraste e clareamento na fase portal, em que apresentam atenuação/sinal semelhante ao fígado circunjacente (Figura 7). Uma minoria dos tumores é hipovascular e é mais bem identificada nas fases portal e de equilíbrio hepático(28,31). Lesões grandes (> 5,0 cm) tendem a ser heterogêneas, podendo apresentar necrose, metamorfose gordurosa e cápsula tumoral(27) (Figura 8). A princípio, qualquer nódulo hipervascular encontrado em paciente hepatopata deve ser considerado altamente suspeito de CHC e, principalmente, quando com mais de 2,0 cm de diâmetro. Um sinal observado na TC e RM com contraste pode ajudar na diferenciação diagnóstica com outras lesões hepáticas (p. ex.: nódulos de regeneração ou displásicos). O CHC, com certa freqüência, apresenta pseudocápsula fibrótica que se realça tardiamente, ou pode apresentar–se hipocontrastado na fase de equilíbrio, em relação ao parênquima hepático adjacente(32).
Alguns autores advogam a utilização do lipiodol via arteriografia, que se liga preferencialmente às células tumorais e é visto em exames de TC realizados tardiamente (após pelo menos três semanas da injeção do lipiodol intra–arterial)(33). Entretanto, este método não vem sendo utilizado com freqüência para o diagnóstico de CHC, pois, alem de invasivo, a intensa impregnação das lesões prejudica o controle evolutivo e de viabilidade. Assim, o lipiodol tem sido usado associado a quimioterápicos e à embolização da artéria hepática, como medidas terapêuticas paliativas para os tumores não–ressecáveis cirurgicamente ou em pacientes aguardando transplante hepático. A avaliação da eficácia do tratamento, apesar de difícil, deve ser realizada pela pesquisa de áreas de realce pelo meio de contraste intravenoso, que usualmente traduzem viabilidade tumoral(33). O rastreamento do CHC é indicado em pacientes com condições clínicas que permitam tratamento curativo, considerando–se a idade, a existência de co–morbidades e o grau de comprometimento da função hepática. Embora seja comum em nosso meio a obtenção de US abdominal e a dosagem sérica de alfafetoproteína a cada seis meses, não existem estudos randomizados e controlados que avaliem a eficácia e o custo/benefício destes testes. Em algumas regiões do mundo, onde é elevada a prevalência de CHC, os testes de rastreamento são mais rigorosos e incluem dosagem de alfafetoproteína a cada dois meses, ultra–som de abdome a cada três meses e TC ou RM a cada seis meses(26). O hepatocarcinoma fibrolamelar é um tipo de hepatocarcinoma incomum que apresenta características clínicas (incluindo prognóstico) e histopatológicas distintas do CHC clássico encontrado no fígado cirrótico. Ocorre preferencialmente em pacientes jovens, sem hepatopatia de base e sem elevação de marcadores tumorais(34). Os aspectos do CHC fibrolamelar freqüentemente encontrados na TC e RM incluem massas grandes em fígados não–cirróticos, lobuladas, bem delimitadas, heterogêneas e com septos radiados e cicatriz central com componentes de fibrose. Calcificações (mais bem avaliadas pela TC) são vistas em cerca de 50% dos casos, quase que exclusivamente na região da cicatriz central. Os estudos dinâmicos com meios de contrastes intravenosos evidenciam vascularização preferencialmente arterial, heterogênea. Nas imagens tardias há uma tendência de impregnação persistente da cicatriz central, o que denota o componente fibroso de tal região (Figura 9). Na RM, o tumor geralmente apresenta hipossinal em T1 e hipersinal heterogêneo em T2, sendo que a cicatriz central possui hipossinal em T2. Tal aspecto ajuda na diferenciação de outros tumores que podem apresentar cicatriz central, especialmente a HNF, na qual a cicatriz central apresenta hipersinal nas imagens de RM ponderadas em T2(34).
COLANGIOCARCINOMA Embora os tumores da via biliar não sejam o escopo de avaliação deste trabalho, descreveremos a seguir as características de alguns colangiocarcinomas que se apresentam como lesões intra–hepáticas e devem entrar no diagnóstico diferencial de lesões hepáticas primárias. O colangiocarcinoma é um adenocarcinoma que se origina do epitélio do ducto biliar. É o segundo tumor primário maligno mais freqüentemente encontrado no fígado, depois do CHC. É associado a litíase intra–hepática, cisto de colédoco, doença de Caroli, colangite esclerosante primária e infecção pelo C. sinensis(35). O tumor pode originar–se de qualquer porção do epitélio biliar e pode ser classificado em intra–hepático (periférico ou hilar) ou extra–hepático. O colangiocarcinoma periférico origina–se de ductos intra–hepáticos secundários e o hilar origina–se dos ductos hepáticos direito e esquerdo ou da sua junção, quando recebe o nome de tumor de Klatskin(36). O colangiocarcinoma periférico normalmente se apresenta como massa sólida, bem delimitada, lobulada e com impregnação periférica pelo meio de contraste na TC e RM. É geralmente volumoso no momento do diagnóstico, porque não costuma causar sintomas nos estágios iniciais, quando freqüentemente não promove dilatação das vias biliares, ao contrário da apresentação hilar. Costuma determinar dilatação focal de ductos biliares circunjacentes em cerca de 30% dos casos e retração capsular (Figura 10). A persistência de impregnação no tumor em fases tardias é um achado freqüentemente descrito e é decorrente da presença de tecido fibrótico intralesional(37–40).
METÁSTASES HEPÁTICAS São as lesões malignas mais freqüentes do fígado. O diagnóstico correto é fundamental para a conduta terapêutica e o prognóstico. A informação precisa do número e da extensão das lesões é pré–requisito para o sucesso da ressecção cirúrgica e monitoramento terapêutico. No paciente oncológico, além do rastreamento de metástases hepáticas, é imperativa a diferenciação entre estas e outros nódulos hepáticos benignos, comumente encontrados de modo acidental em estudos de imagem(41). A US tem sensibilidade limitada para a detecção de metástases hepáticas, variando entre 50% e 70%(42). A maioria das metástases não–detectadas pela US são as pequenas, principalmente as menores que 1,0 cm, ou as isoecóicas em relação ao parênquima hepático. O aspecto mais característico de metástase hepática na US é o de lesão hipo ou isoecogênica ao parênquima circunjacente rodeada por um halo hiperecogênico, o que confere à lesão o conhecido aspecto "em alvo" ou "olho de boi". A presença do halo tem alta sensibilidade para o diagnóstico de malignidade (cerca de 85%)(43). Apesar do menor custo e da maior disponibilidade, o método apresenta menor reprodutibilidade em relação à TC e RM, o que pode dificultar o controle evolutivo das lesões(42,43). A TC, junto com a RM, é considerada o principal método de imagem para o rastreamento de metástases hepáticas no paciente oncológico, por oferecer melhor resolução espacial e maiores sensibilidade (ao redor de 75%) e especificidade na detecção e caracterização de lesões focais hepáticas. A TC também permite avaliar eventuais alterações hepáticas difusas associadas, além de estudar o restante do abdome. A utilização da tecnologia espiral, especialmente com tomógrafos utilizando múltiplas fileiras de detectores (multislice), oferece a possibilidade de realizar o estudo hepático sem e com contraste intravenoso em múltiplas fases (pré–contraste, arterial, portal e de equilíbrio hepático), o que é imprescindível para a adequada avaliação do órgão, especialmente no contexto de malignidade. Possibilita, ainda, uma adequada avaliação das árvores arterial, venosa e portal hepáticas. Reconstruções angiográficas tridimensionais podem ser feitas, o que permite estabelecer a relação das lesões com os maiores ramos vasculares(44,45). A maioria das metástases é hipovascular e apresenta–se como nódulos hipoatenuantes em relação ao parênquima hepático na fase portal, com realce heterogêneo ou anelar pelo meio de contraste (Figura 11). Algumas neoplasias (p. ex.: carcinomas de células renais, de tireóide, de mama, tumores carcinóides, neuroendócrinos e melanoma) podem promover metástases hepáticas hipervasculares, que são mais bem identificadas na fase arterial devido à impregnação precoce e fugaz do meio de contraste, tendendo a tornarem–se isoatenuantes ao parênquima na fase portal(44,45) (Figura 12).
Nódulos hipoatenuantes pequenos, especialmente os menores que 1,0 cm, podem ser de difícil caracterização na TC. Nestes casos, a RM pode auxiliar na avaliação diagnóstica, tendo em vista a alta especificidade do método na caracterização de pequenos cistos e hemangiomas, lesões comumente presentes, inclusive no grupo de pacientes oncológicos(46). A RM apresenta sensibilidade (ao redor de 75%) e especificidade muito semelhantes à da TC na avaliação de lesões hepáticas secundárias. A técnica convencional para avaliação do fígado utiliza o meio de contraste paramagnético por via intravenosa, com séries adquiridas durante as fases arterial, portal e de equilíbrio hepático, semelhante à TC. As imagens ponderadas em T2 são muito importantes na caracterização das lesões e representam uma vantagem adicional em relação à TC, particularmente nas lesões pequenas(42,46) (Figura 11). A utilização de meios de contraste hepato–específicos, como o óxido de ferro superparamagnético, parece aumentar a acurácia do método na detecção de metástases, especialmente as de pequenas dimensões(47). No entanto, este tipo de meio de contraste não tem sido utilizado de forma rotineira no nosso meio, por causa do seu maior custo.
CONCLUSÃO Com a disseminação de equipamentos de diagnóstico por imagem e sua crescente utilização, tem sido cada vez mais comum a ocorrência de nódulos hepáticos incidentalmente encontrados em exames de imagem ou em pacientes em rastreamento tumoral(48–51). A evolução tecnológica destes equipamentos tem permitido detectar lesões cada vez menores, o que dificulta a sua caracterização e que pode ser ulteriormente comprometida pelas freqüentes pseudolesões hepáticas observadas em exames de TC e RM com contraste(52,53). Reconhecer os principais aspectos de imagem dos tumores hepáticos mais comuns e algumas das suas características(54) pode ajudar o radiologista a contribuir concreta e positivamente na abordagem diagnóstica e no manejo deste grupo de pacientes.
REFERÊNCIAS 1. Edmondson HA, Peters RL. Neoplasms of the liver. In: Schift L, Schift ET, editors. Diseases of the liver. Philadelphia: Lippincott; 1982. p. 1114–45. [ ] 2. Tiferes DA, D'Ippolito G, Szejnfeld J. Ressonância magnética dos hemangiomas hepáticos: avaliação das características morfológicas e quantitativas. Radiol Bras. 2003;36:1–9. [ ] 3. Nelson RC, Chezmar JL. Diagnostic approach to hepatic hemangiomas. Radiology. 1990;176:11–3. [ ] 4. Kojimahara M. Ultrastructural study of hemangiomas. 4. Cavernous hemangioma of the liver. Acta Pathol Jpn. 1986;36:1477–85. [ ] 5. Semelka RC, Brown ED, Ascher SM, et al. Hepatic hemangiomas: a multi–institutional study of appearance on T2–weighted and serial gadolinium–enhanced gradient–echo MR images. Radiology. 1994;192:401–6. [ ] 6. Leslie DF, Johnson CD, MacCarty RL, et al. Single–pass CT of hepatic tumors: value of globular enhancement in distinguishing hemangiomas from hypervascular metastases. AJR Am J Roentgenol. 1995;165:1403–6. [ ] 7. Vilgrain V, Boulos L, Vullierme MP, et al. Imaging of atypical hemangiomas of the liver with pathologic correlation. Radiographics. 2000;20: 379–97. [ ] 8. D'Ippolito G, Appezzato LF, Ribeiro ACR, et al. Apresentações incomuns do hemangioma hepático: ensaio iconográfico. Radiol Bras. 2006;39: 219–25. [ ] 9. Birnbaum BA, Weinreb JC, Megibow AJ, et al. Definitive diagnosis of hepatic hemangiomas: MR imaging versus Tc–99m–labelled red blood cell SPECT. Radiology. 1990;176:95–101. [ ] 10. Moody AR, Wilson SR. Atypical hepatic hemangioma: a suggestive sonographic morphology. Radiology. 1993;188:413–7. [ ] 11. Nguyen BN, Fléjou JF, Terris B, et al. Focal nodular hyperplasia of the liver: a comprehensive pathologic study of 305 lesions and recognition of new histologic forms. Am J Surg Pathol. 1999; 23:1441–54. [ ] 12. Wanless IR, Mawdsley C, Adams R. On the pathogenesis of focal nodular hyperplasia of the liver. Hepatology. 1985;5:1194–200. [ ] 13. Mathieu D, Kobeiter H, Maison P, et al. Oral contraceptive use and focal nodular hyperplasia of the liver. Gastroenterology. 2000;118:560–4. [ ] 14. Mortelé KJ, Praet M, Van Vlierberghe H, et al. CT and MR imaging findings in focal nodular hyperplasia of the liver: radiologic–pathologic correlation. AJR Am J Roentgenol. 2000;175:687–92. [ ] 15. Hussain SM, Terkivatan T, Zondervan PE, et al. Focal nodular hyperplasia: findings at state–of–the–art MR imaging, US, CT, and pathologic analysis Radiographics. 2004;24:3–17. [ ] 16. Soe KL, Soe M, Gluud C. Liver pathology associated with the use of anabolic–androgenic steroids. Liver. 1992;12:73–9. [ ] 17. Labrune P, Trioche P, Duvaltier I, et al. Hepatocellular adenomas in glycogen storage disease type I and III: a series of 43 patients and review of the literature. J Pediatr Gastroenterol Nutr. 1997;24:276–9. [ ] 18. Paulson EK, McClellan JS, Washington K, et al. Hepatic adenoma: MR characteristics and correlation with pathologic findings. AJR Am J Roentgenol. 1994;163:113–6. [ ] 19. Ichikawa T, Federle MP, Grazioli L, et al. Hepatocellular adenoma: multiphasic CT and histopathologic findings in 25 patients. Radiology. 2000; 214:861–8. [ ] 20. Ault GT, Wren SM, Ralls PW, et al. Selective management of hepatic adenomas. Am Surg. 1996;62:825–9. [ ] 21. Grazioli L, Federle MP, Ichikawa T, et al. Liver adenomatosis: clinical, histopathologic, and imaging findings in 15 patients. Radiology. 2000; 216:395–402. [ ] 22. Foster JH, Berman MM. The malignant transformation of liver cell adenomas. Arch Surg. 1994; 129:712–7. [ ] 23. Grazioli L, Federle MP, Brancatelli G, et al. Hepatic adenomas: imaging and pathologic findings. Radiographics. 2001;21:877–92. [ ] 24. Fléjou JF, Barge J, Menu Y, et al. Liver adenomatosis: an entity distinct from liver adenoma? Gastroenterology. 1985;89:1132–8. [ ] 25. Arrivé L, Fléjou JF, Vilgrain V, et al. Hepatic adenoma: MR findings in 51 pathologically proved lesions. Radiology. 1994;193:507–12. [ ] 26. El–Serag HB, Mason AC. Rising incidence of hepatocellular carcinoma in the United States. N Engl J Med. 1999;340:745–50. [ ] 27. Baron RL, Peterson MS. From the RSNA refresher courses: Screening the cirrhotic liver for hepatocellular carcinoma with CT and MR imaging: opportunities and pitfalls. Radiographics. 2001;21:117–32. [ ] 28. Peterson MS, Baron RL, Marsh JW Jr, et al. Pretransplantation surveillance for possible hepatocellular carcinoma in patients with cirrhosis: epidemiology and CT–based tumor detection rate in 430 cases with surgical pathologic correlation. Radiology. 2000;217:743–9. [ ] 29. International Working Party. Terminology of nodular hepatocellular lesions. Hepatology. 1995; 22:983–93. [ ] 30. Murakami T, Nakamura H, Hori S, et al. CT and MRI of siderotic regenerating nodules in hepatic cirrhosis. J Comput Assist Tomogr. 1992;16:578–82. [ ] 31. Krinsky GA, Lee VS, Theise ND, et al. Hepatocellular carcinoma and dysplastic nodules in patients with cirrhosis: prospective diagnosis with MR imaging and explantation correlation. Radiology. 2001;219:445–54. [ ] 32. D'Ippolito G, Abreu L, Borri ML, et al. Apresentações incomuns do hepatocarcinoma: ensaio iconográfico. Radiol Bras. 2006;39:137–43. [ ] 33. Cammà C, Schepis F, Orlando A, et al. Transarterial chemoembolization for unresectable hepatocellular carcinoma: meta–analysis of randomized controlled trials. Radiology. 2002;224:47–54. [ ] 34. Ichikawa T, Federle MP, Grazioli L, et al. Fibrolamellar hepatocellular carcinoma: imaging and pathologic findings in 31 recent cases. Radiology. 1999;213:352–61. [ ] 35. Sherlock S, Dooley J. Disease of the liver and biliary system. 10th ed. London: Blackwell; 1997. [ ] 36. Nakanuma Y, Minato H, Kida T, et al. Pathology of cholangiocellular carcinoma. In: Tobe T, Kameda H, Okudaira M, et al., editors. Primary liver cancer in Japan. Tokyo: Springer–Verlag; 1994. p. 39–50. [ ] 37. Kim TK, Choi BI, Han JK, et al. Peripheral cholangiocarcinoma of the liver: two–phase spiral CT findings. Radiology. 1997;204:539–43. [ ] 38. Lee JW, Han JK, Kim TK, et al. CT features of intraductal intrahepatic cholangiocarcinoma. AJR Am J Roentgenol. 2000;175:721–5. [ ] 39. Choi BI, Han JK, Kim TK. Benign and malignant tumors of the biliary tree. In: Gazelle SG, editor. Hepatobiliary and pancreatic radiology. New York: Thieme; 1998. p. 630–76. [ ] 40. Choi BI, Han JK, Kim TK. Diagnosis and staging of cholangiocarcinoma by computed tomography. In: Meyers MA, editor. Neoplasms of the digestive tract: imaging, staging and management. Philadelphia: Lippincott–Raven; 1998. p. 503–16. [ ] 41. Sahani DV, Kalva SP. Imaging the liver. Oncologist. 2004;9:385–97. [ ] 42. Kinkel K, Lu Y, Both M, et al. Detection of hepatic metastases from cancers of the gastrointestinal tract by using noninvasive imaging methods (US, CT, MR imaging, PET): a meta–analysis. Radiology. 2002;224:748–56. [ ] 43. Wernecke K, Vassallo P, Bick U, et al. The distinction between benign and malignant liver tumors on sonography: value of a hypoechoic halo. AJR Am J Roentgenol. 1992;159:1005–9. [ ] 44. Bree RL, Greene FL, Ralls PW, et al. Suspected liver metastases. American College of Radiology. ACR Appropriateness Criteria. Radiology. 2000; 215:213–24. [ ] 45. Soyer P, Poccard M, Boudiaf M, et al. Detection of hypovascular hepatic metastases at triple–phase helical CT: sensitivity of phases and comparison with surgical and histopathologic findings. Radiology. 2004;231:413–20. [ ] 46. Mueller GC, Hussain HK, Carlos RC, et al. Effectiveness of MR imaging in characterizing small hepatic lesions: routine versus expert interpretation. AJR Am J Roentgenol. 2003;180:673–80. [ ] 47. Hagspiel KD, Neidl KF, Eichenberger AC, et al. Detection of liver metastases: comparison of superparamagnetic iron oxide–enhanced and unenhanced MR imaging at 1.5 T with dynamic CT, intraoperative US, and percutaneous US. Radiology. 1995;196:471–8. [ ] 48. Machado MM, Rosa ACF, Lemes MS, et al. Hemangiomas hepáticos: aspectos ultra–sonográficos e clínicos. Radiol Bras. 2006;39:441–6. [ ] 49. Machado MM, Rosa ACF, Barros N, et al. Múltiplos pequenos nódulos hepáticos hiperecogênicos sem reverberação sonora posterior: outra forma de apresentação dos hamartomas dos ductos biliares. Radiol Bras. 2005;38:389–91. [ ] 50. Machado MM, Rosa ACF, Herman P, et al. Avaliação dos tumores hepáticos ao Doppler. Radiol Bras. 2004;37:371–6. [ ] 51. Machado MM, Rosa ACF, Barros N, et al. Hemangiomas hipoecogênicos. Radiol Bras. 2003;36: 273–6. [ ] 52. Meirelles GSP, Tiferes DA, D'Ippolito G. Pseudolesões hepáticas na ressonância magnética: ensaio iconográfico. Radiol Bras. 2003;36:305–9. [ ] 53. Meirelles GSP, D'Ippolito G. Pseudolesões hepáticas na tomografia computadorizada helicoidal: ensaio iconográfico. Radiol Bras. 2003;36:229–35. [ ] 54. Bezerra ASA, D'Ippolito G, Martelli P, et al. Calcificações hepáticas: freqüência e significado. Radiol Bras. 2003;36:199–205. [ ]
Recebido para publicação em 8/6/2007. Aceito, após revisão, em 28/8/2007.
* Trabalho realizado no Departamento de Diagnóstico por Imagem da Escola Paulista de Medicina/Universidade Federal de São Paulo (Unifesp/EPM) e no Fleury – Medicina e Saúde, São Paulo, SP, Brasil. |
|
Av. Paulista, 37 - 7° andar - Conj. 71 - CEP 01311-902 - São Paulo - SP - Brazil - Phone: (11) 3372-4544 - Fax: (11) 3372-4554