Radiologia Brasileira - Publicação Científica Oficial do Colégio Brasileiro de Radiologia
AMB - Associação Médica Brasileira CNA - Comissão Nacional de Acreditação
 Vol. 51 nº 5 - Set. / Out. of 2018
Vol. 51 nº 5 - Set. / Out. of 2018
|
ARTIGOS ORIGINAIS
|
|
|
|
|
Autho(rs): Arine Santos Peçanha1; Alexandra Maria Monteiro1; Fernanda Mussi Gazolla2; Isabel Rey Madeira1; Maria Alice Neves Bordallo1; Cecilia N. Miranda Carvalho1; Luciana Tricai Cavalini1 |
|
|
Descritores: Criança; Ultrassonografia; Gordura subcutânea; Gordura intra-abdominal. |
|
|
Resumo: INTRODUÇÃO
A obesidade infantil é considerada problema mundial de saúde pública(1), sendo a causa mais comum de resistência à insulina, dentre outras alterações metabólicas(2,3). Nesse contexto, o acúmulo da gordura no abdome e a sua distribuição têm sido descritos como importante fator de risco para alterações metabólicas e doenças cardiovasculares(4,5). Diferentes métodos de imagem(6-11) têm sido usados para avaliação da distribuição da gordura abdominal, como a tomografia computadorizada, a ressonância magnética e a ultrassonografia, sendo este último o de execução mais rápida, fácil aceitação e isento de radiação ionizante, de grande importância, sobretudo na infância(12). O objetivo deste estudo é utilizar a ultrassonografia como método de avaliação da distribuição dos componentes da gordura abdominal e correlacionar estes com as principais alterações metabólicas em crianças pré-púberes obesas. MATERIAIS E MÉTODOS Estudo observacional transversal, realizado no Hospital Universitário Pedro Ernesto da Universidade do Estado do Rio de Janeiro, incluindo 77 crianças pré-púberes, segundo o método de Tanner, classificadas como obesas pelo índice de massa corpórea maior ou igual ao percentil 97(13), sendo 33 meninas e 44 meninos, com média de idade de 7,31 anos (5 a 11 anos incompletos), sem doenças associadas e/ou intervenção terapêutica prévia para perda de peso. Foi realizado, também, estudo com grupo controle incluindo 31 crianças eutróficas pré-púberes com média de idade de 7,32 anos (17 meninas e 14 meninos). A ultrassonografia foi realizada por dois médicos com mais de 10 anos de experiência, de modo independente, em posição supina, com transdutor situado cerca de 2 cm acima da cicatriz umbilical, com todas as aferições no plano axial, sem pressão do transdutor sobre o abdome. Para a medida da espessura da parede abdominal (EPA) foi considerada a distância entre a pele e a face anterior da linha alba (Figura 1). Para a espessura da gordura intra-abdominal (EIA), mensurou-se a distância entre a face posterior da linha alba até a parede anterior da aorta (Figura 2). Foi utilizado aparelho de ultrassonografia Aplio XG, modelo SSA-790A (Toshiba Medical Systems; Tóquio, Japão), com transdutor convexo de 3,5 MHz para a medida da EIA e transdutor linear de 12 MHz para a medida da EPA. Não foi solicitado preparo prévio ao exame. O tempo de execução médio foi menor que 10 minutos, bem tolerado por todos os pacientes. 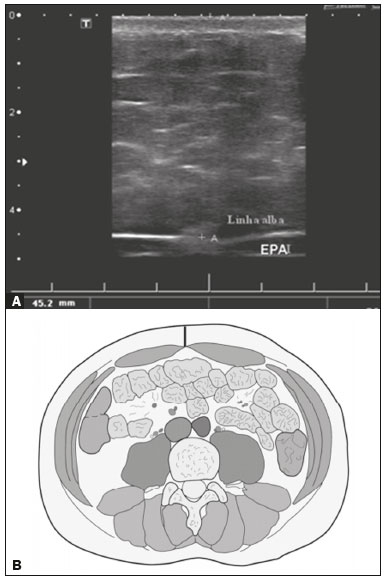 Figura 1. A: Corte axial no abdome, cerca de 2 cm abaixo da emergência da artéria mesentérica superior. Os marcadores (+) demonstram os limites determinados pela pele e a face anterior da linha alba. B: Demonstração esquemática. 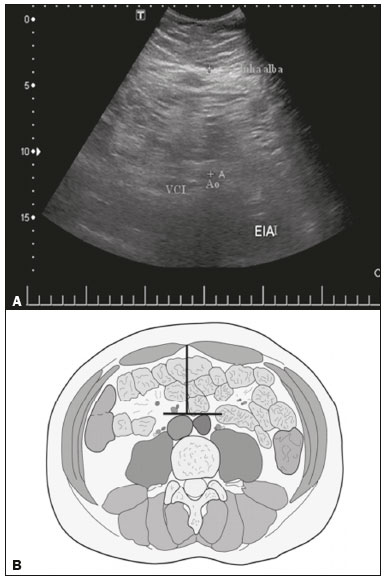 Figura 2. A: Corte axial no abdome, cerca de 2 cm abaixo da emergência da artéria mesentérica superior. Os marcadores (+) demonstram os limites determinados pela face posterior da linha alba e a parede anterior da aorta (Ao). VCI, veia cava inferior. B: Demonstração esquemática. Para avaliação das alterações metabólicas foram realizadas dosagens séricas em jejum de: HDL, triglicerídeos, glicose, insulina e o índice homeostatic model assessment for insulin resistance (HOMA-IR), que foi calculado pela multiplicação dos valores obtidos de glicose (mmol/L) e insulina (µIU/mL), divididos por 22,5. O ponto de corte para normalidade foi definido como 2,5(14). Os dados foram armazenados em programa Excel for Windows versão 8.0 (Microsoft Corporation; Redmond, WA, EUA) e analisados pelo programa R, versão 3.1.0 e 3.1.1(The R Foundation for Statistical Computing; Viena, Áustria). As variáveis contínuas estudadas foram HDL, triglicerídeos, glicemia de jejum, EIA (mm), EPA (mm) e as categóricas foram sexo e status do HOMA-IR, do HDL, da hipertrigliceridemia e da intolerância à glicose. Foram utilizados o teste de Wilcoxon para comparação das medianas e o teste do qui-quadrado para avaliação de um possível ponto de corte na EIA e EPA que apresentaram maior associação com as alterações metabólicas avaliadas. Foram ajustados modelos de regressão linear multivariada para os parâmetros EIA e EPA, que foram considerados variáveis dependentes. As variáveis independentes incluídas no modelo inicial foram: glicemia de jejum, HDL-colesterol, triglicerídeos, HOMA-IR, idade e sexo. Em todos os testes estatísticos adotou-se o nível de confiança de 95% (p < 0,05). RESULTADOS Nas crianças pré-púberes obesas, a mediana da EIA foi 41,40 mm (desvio-padrão [DP] de 11,51 mm) e da EPA foi 19,80 mm (DP de 6,74 mm), e nos eutróficos foi 24,40 mm (DP de 8,36 mm) e 5,80 mm (DP de 2,12 mm), respectivamente, ambas sem diferença em relação ao gênero. Em relação às alterações metabólicas, nos obesos observou-se que 23 crianças tinham HOMA-IR alterado, 50 tinham HDL diminuído, 4 tinham intolerância à glicose e 13 tinham hipertrigliceridemia, com 22 apresentando duas ou mais dessas alterações. Foi realizada comparação das medianas da EIA e da EPA entre os grupos com e sem as alterações metabólicas analisadas individualmente (Tabela 1). Com base nessa análise, observou-se diferença significativa nas correlações das medidas da EIA e da EPA com o HOMA-IR alterado (p < 0,031 e p < 0,001, respectivamente) e da EPA em relação a hipertrigliceridemia (p < 0,038). 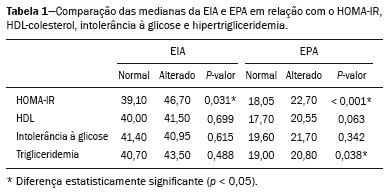 Foram realizados modelos de regressão linear multivariada para os parâmetros EIA e EPA utilizando como variáveis independentes: glicemia de jejum, HDL-colesterol, triglicerídeos, HOMA-IR, idade e sexo. Nesse modelo não se observou relação da hipertrigliceridemia com a EPA. Destacou-se a associação direta entre o HOMA-IR e ambas as espessuras, de modo que para cada aumento de uma unidade de medida de HOMA-IR houve aumento de 1,313 mm do EIA (p < 0,0262) e amento de 1,021 mm do EPA (p < 0,0027), como demonstrado nas Tabelas 2 e 3. No entanto, observou-se que a associação entre a EIA e o HOMA-IR perde significância estatística com a inserção das variáveis sexo e idade no modelo, o que não ocorre quando avaliamos a EPA (Tabela 2). 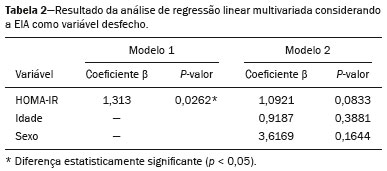 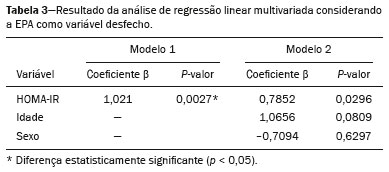 DISCUSSÃO Apesar de a obesidade infantil ser considerada como uma epidemia mundial, há poucos estudos correlacionando medidas da distribuição da gordura abdominal por métodos de diagnóstico por imagem, com alterações metabólicas séricas, especialmente em crianças pré-púberes. Nessa faixa etária, ainda não há ação dos esteroides sexuais que podem interferir na avaliação metabólica(15,16). O presente estudo utilizou a ultrassonografia como método de avaliação da distribuição da gordura abdominal em correlação com a glicemia de jejum, HDL-colesterol, triglicerídeos e o HOMA-IR em 77 crianças pré-púberes obesas, em que somente o HOMA-IR apresentou relação estatisticamente significante com a EIA e a EPA, notadamente com este último parâmetro. Em relação ao metabolismo lipídico, Semiz et al.(17) também não encontraram relação com a EIA, diferentemente de outros autores, que identificaram correlação positiva entre a EIA e a hipertrigliceridemia(18,19), além de Jung et al.(19), que encontraram, também, correlação negativa da EIA com o HDL-colesterol. Esses estudos correlatos(17-19), no entanto, avaliaram crianças pré-púberes e púberes e com maior média da faixa etária, em comparação com o nosso estudo, o que pode ter influenciado os achados, tendo em vista que a literatura demonstra que as alterações no metabolismo lipídico podem ser influenciadas pelo grau de maturidade sexual(20), pela ação dos esteroides sexuais de crianças em diferentes graus de maturação sexual. A análise da EPA não foi considerada em nenhum dos estudos citados(17-19,20). A glicemia de jejum foi avaliada em correlação com a distribuição da gordura abdominal em diferentes estudos(17,21), sem apresentar relação estatisticamente significante, em acordo com os nossos achados. O HOMA-IR, que reflete a resistência insulínica(22), portanto, um relevante marcador de alteração no metabolismo, foi descrito em diferentes estudos(17-19,21), com destaque aos de Reinehr et al.(18) e Reyes et al.(21), que também identificaram relação da EIA com o HOMA-IR. Não foi possível correlacionar nossos achados em relação à EPA com alguns dos estudos descritos(18,19,21), pois esta medida não foi realizada em tais estudos. O estudo de Semiz et al.(17), em particular, não encontrou relação estatisticamente significante em relação à EIA, mas encontrou em relação à EPA, tal qual os nossos achados. O estudo de Semiz et al.(17) analisou 33 crianças com idade média de 12 anos (± 2.7 anos), sem contudo descrever a classificação entre púberes e impúberes, especificamente, o que, eventualmente, pode ter sido a causa dos achados semelhantes aos nossos por uma possível prevalência do grupo impúbere sobre o púbere. De maneira geral, na distribuição da adiposidade nas crianças, independente do sexo, observa-se predomínio do componente subcutâneo(23), assim como nossos achados no grupo de impúberes obesos. Essa predominância parece estar relacionada positivamente com a alteração do HOMA-IR, no caso da obesidade, podendo sugerir algum tipo de efeito da EPA sobre o desenvolvimento da resistência insulínica, diferente do que está descrito na população adulta(17). A identificação, portanto, de forma global nos nossos resultados do predomínio de acúmulo de gordura na parede abdominal pode ser considerada como um possível fator relacionado à resistência insulínica. Novos estudos precisam ser realizados, considerando em separado a puberdade da idade cronológica, para que possam ser estabelecidas as correlações entre as alterações metabólicas da obesidade na infância e a distribuição da gordura abdominal. CONCLUSÃO A EPA em pré-púberes obesos, medida pela ultrassonografia, demonstrou ter maior relação com o HOMA-IR, determinante de resistência insulínica, em relação ao metabolismo lipídico e à glicemia. REFERÊNCIAS 1. Broyles ST, Denstel KD, Church TS, et al. The epidemiological transition and the global childhood obesity epidemic. Int J Obes Suppl. 2015;5(Suppl 2):S3-8. 2. Serrano Jr CV, Gomes FLT, Torres TCA, et al. Obesidade e doença cardiovascular tromboembólica. In: Mancini MC, coordenador. Tratado de obesidade. Rio de Janeiro, RJ: Guanabara Koogan; 2015. p. 290-5. 3. Ludwig DS. Childhood obesity-the shape of things to come. N Engl J Med. 2007;357:2325-7. 4. Daniels SR, Morrison JA, Sprecher DL, et al. Association of body fat distribution and cardiovascular risk factors in children and adolescents. Circulation. 1999;99:541-5. 5. Owens S, Gutin B, Ferguson M, et al. Visceral adipose tissue and cardiovascular risk factors in obese children. J Pediatr. 1998;133:41-5. 6. Mook-Kanamori DO, Holzhauer S, Hollestein LM, et al. Abdominal fat in children measured by ultrasound and computed tomography. Ultrasound Med Biol. 2009;35:1938-46. 7. Image Gently [internet]. Radiation. [cited 2016 June 10]. Available from: http://www.imagegently.org. 8. Semiz S, Ozgören E, Sabir N. Comparison of ultrasonographic and anthropometric methods to assess body fat in childhood obesity. Int J Obes (Lond). 2007;31:53-8. 9. Armellini F, Zamboni M, Robbi R, et al. Total and intra-abdominal fat measurements by ultrasound and computerized tomography. Int J Obes Relat Metab Disord. 1993;17:209-14. 10. Lobstein T, Baur L, Uauy R. Obesity in children and young people: a crisis in public health. Obes Rev. 2004;5 Suppl 1:4-104. 11. Sabir N, Pakdemirli E, Sermez Y, et al. Sonographic assessment of changes in thickness of different abdominal fat layers in response to diet in obese women. J Clin Ultrasound. 2003;31:26-30. 12. Sakuno T, Tomita LM, Tomita CM, et al. Sonographic evaluation of visceral and subcutaneous fat in obese children. Radiol Bras. 2014;47:149-53. 13. de Onis M, Onyango AW, Borghi E, et al. Development of a WHO growth reference for school-aged children and adolescents. Bull World Health Organ. 2007;85:660-7. 14. Madeira IR, Carvalho CNN, Gazolla FM, et al. Ponto de corte do índice homeostatic model assessment for insulin resistance (HOMA- IR) avaliado pela curva receiver operating characteristic (ROC) na detecção de síndrome metabólica em crianças pré-púberes com excesso de peso. Arq Bras Endocrinol Metab. 2008;52:1466-73. 15. Aycan Z, Berberoglu M, Ocal G, et al. Relationship between plasma leptin, insulin and tumor necrosis factor alpha in obese children. J Pediatr Endocrinol Metab. 2005;18:275-84. 16. Druet C, Dabbas M, Baltakse V, et al. Insulin resistance and the metabolic syndrome in obese French children. Clin Endocrinol (Oxf). 2006;64:672-8. 17. Semiz S, Ozgoren E, Sabir N, et al. Body fat distribution in childhood obesity: association with metabolic risk factors. Indian J Pediatr. 2008;45:457-62. 18. Reinehr T, Wunsch R. Relationships between cardiovascular risk profile, ultrasonographic measurement of intra-abdominal adipose tissue, and waist circumference in obese children. Clin Nutr. 2010;29:24-30. 19. Jung JH, Jung MK, Kim KE, et al. Ultrasound measurement of pediatric visceral fat thickness: correlations with metabolic and liver profiles. Ann Pediatr Endocrinol Metab. 2016;21:75-80. 20. Bertrais S, Balkau B, Charles MA, et al. Puberty-associated differences in total cholesterol and triglyceride levels according to sex in French children aged 10-13 years. Ann Epidemiol. 2000;10:316-23. 21. Reyes M, Espinoza A, Rebollo MJ, et al. Ultrasound measurements of intra-abdominal adiposity and factors associated with cardiovascular risk in obese children. Rev Med Chil. 2010;138:152-9. 22. Siegel MJ, Hildebolt CF, Bae KT, et al. Total and intraabdominal fat distribution in preadolescents and adolescents: measurement with MR imaging. Radiology. 2007;242:846-56. 23. Slyper AH. Childhood obesity, adipose tissue distribution, and the pediatric practitioner. Pediatrics. 1998;102:e4. 1. Universidade do Estado do Rio de Janeiro (UERJ), Rio de Janeiro, RJ, Brasil 2. Hospital Universitário Pedro Ernesto da Universidade do Estado do Rio de Janeiro (HUPE-UERJ), Rio de Janeiro, RJ, Brasil Correspondência: Dra. Arine Santos Peçanha Universidade do Estado do Rio de Janeiro Rua São Francisco Xavier, 524, Maracanã Rio de Janeiro, RJ, Brasil, 20550-900 E-mail: arinep@yahoo.com.br Received December 21, 2016 Accepted after revision September 22, 2017 Trabalho realizado no Hospital Universitário Pedro Ernesto da Universidade do Estado do Rio de Janeiro (HUPE-UERJ), Rio de Janeiro, RJ, Brasil |
|
Av. Paulista, 37 - 7° andar - Conj. 71 - CEP 01311-902 - São Paulo - SP - Brazil - Phone: (11) 3372-4544 - Fax: (11) 3372-4554