Radiologia Brasileira - Publicação Científica Oficial do Colégio Brasileiro de Radiologia
AMB - Associação Médica Brasileira CNA - Comissão Nacional de Acreditação
 Vol. 41 nº 5 - Set. / Out. of 2008
Vol. 41 nº 5 - Set. / Out. of 2008
|
ARTIGO ORIGINAL
|
|
|
|
|
Autho(rs): Gustavo Lemos Pelandré, Maria Célia Djahjah, Luiz Felipe Nobre, Emerson Leandro Gasparetto, Edson Marchiori, Bruno Vilhena Pereira, Marcus Valadão, Eduardo Linhares |
|
|
Descritores: Tumores do estroma gastrintestinal, Neoplasias gástricas, Tomografia computadorizada helicoidal |
|
|
Resumo: VDoutor em Radiologia, Professor Titular do Departamento de Radiologia da Universidade Federal Fluminense (UFF), Niterói, RJ, Coordenador Adjunto do Curso de Pós-Graduação em Radiologia da Universidade Federal do Rio de Janeiro (UFRJ), Rio de Janeiro, RJ, Brasil
INTRODUÇÃO O tumor estromal gastrintestinal (GIST - gastrointestinal stromal tumor) é uma doença abdominal incomum que constitui aproximadamente 80% dos tumores mesenquimais do trato digestivo e 5% de todos os sarcomas(1). Cerca de 4.500 a 6.000 casos de GIST são diagnosticados anualmente nos EUA, com pico de incidência entre a sexta e sétima décadas de vida. A doença pode comprometer qualquer porção do trato gastrintestinal, sendo o estômago o órgão mais acometido (45% a 65%), seguido pelo delgado (15% a 25%), cólon (5% a 10%) e outras regiões da cavidade abdominal (5%)(2). Embora essa neoplasia mensenquimal seja conhecida há décadas, descobertas recentes permitiram melhor conhecimento de sua origem celular, bem como dos eventos moleculares envolvidos no desenvolvimento da lesão(2). Até cerca de 20 anos, acreditava-se que a maioria dos tumores mesenquimais gastrintestinais eram provenientes da musculatura lisa, sendo denominados de "leiomiomas" e "leiomiossarcomas". A utilização da microscopia eletrônica e da imuno-histoquímica, todavia, evidenciou que apenas alguns desses tumores apresentavam características de músculo liso(3). Posteriormente, alguns autores demonstraram que esses tumores também apresentavam características de diferenciação neuronal, designando-os de "plexossarcomas" e "tumores gastrintestinais do nervo autonômico"(4). Só recentemente foi esclarecido que esta neoplasia constitui uma entidade bem definida denominada GIST, mediante descoberta de sua origem a partir das células intersticiais de Cajal(5) e da expressão da proteína KIT(6). O KIT é um receptor transmembrana com atividade de tirosina quinase, responsável por várias funções celulares, como adesão, apoptose e diferenciação celular. No GIST, a mutação do gene kit é responsável pela ativação constitutiva na proteína KIT, que causa estímulo sem oposição para proliferação celular(7). Uma das mais promissoras descobertas recentes do tratamento do câncer tem sido a utilização de terapia de alvo molecular, sendo o GIST o melhor exemplo de aplicação desta modalidade terapêutica. A descoberta do mesilato de imatinib revolucionou o tratamento do GIST, por ser a primeira droga a agir especificamente na alteração molecular responsável pela etiologia da doença(2). O imatinib é uma droga com alvo molecular definido, que interfere na atividade tirosina quinase dos receptores KIT(8). A tomografia computadorizada é o exame de imagem mais importante para a detecção e caracterização do GIST, uma vez que fornece informações sobre o tamanho do tumor, a localização anatômica, o padrão de crescimento, a evidência de necrose, a invasão de órgãos adjacentes e metástases, permitindo também a monitoração do tratamento e a avaliação da progressão da doença(2,9). O objetivo deste trabalho é descrever os aspectos tomográficos de um grupo de 14 pacientes com GIST gástrico, enfatizando a importância deste exame de imagem na caracterização da lesão em sua topografia mais comum, bem como na definição do diagnóstico diferencial.
MATERIAIS E MÉTODOS O modelo de estudo utilizado foi observacional, descritivo, tipo série de casos. Foram selecionados para o estudo 41 pacientes admitidos no Hospital do Câncer I - Instituto Nacional de Câncer, no período de janeiro de 1999 a dezembro de 2006, com diagnóstico histopatológico de GIST. Destes, foram excluídos 9 pacientes que não haviam realizado estudo imuno-histoquímico e 18 pacientes que não apresentavam tomografia computadorizada abdominal realizada antes do tratamento oncológico, ou cujos exames estavam incompletos ou não foram encontrados. A população deste estudo constou de nove pacientes do sexo feminino (64,3%) e cinco do sexo masculino (35,7%). A média de idade observada foi de 59,4 ± 18 anos (média ± desvio-padrão). As manifestações clínicas observadas foram: dor ou desconforto abdominal (n = 10), emagrecimento (n = 4), aumento de volume abdominal (n = 3), hematêmese (n = 1), melena (n = 1), vômitos (n = 1) e febre (n = 1). Um paciente apresentava-se assintomático e o tumor foi achado incidental durante a realização de ultra-sonografia abdominal. Nove pacientes realizaram tomografia computadorizada em nossa instituição, em aparelho helicoidal modelo Shimadzu SCT 7000 TS (Shimadzu Corp.; Kyoto, Japão), através de aquisições axiais com colimação de 5 mm e intervalo de reconstrução de 7 mm, pitch de 1,5, 120 kV e 130 mA. Foram administrados 1.000 ml de contraste iodado iônico diluído a 2%, via oral, uma hora antes de cada exame (diatrizoato de meglumina). Foram obtidas duas aquisições, antes e após a administração de 100 ml de contraste venoso iodado não-iônico (ioexol 300 mgI/ml, 2 ml/s), 55 segundos após o início da infusão. Cinco pacientes realizaram tomografia computadorizada em outras instituições, com técnicas variadas, sendo que todos utilizaram contraste oral e três utilizaram contraste venoso. As tomografias computadorizadas foram analisadas de forma independente por três médicos radiologistas. Nos casos discordantes, a decisão final foi definida por consenso. As características avaliadas foram: local da lesão, dimensões, homogeneidade, contornos, limites, morfologia, padrão e intensidade do realce pelo meio de contraste venoso, padrão de crescimento, invasão de órgãos adjacentes, presença de ulceração, fístula, calcificações, infiltração da gordura mesentérica, linfonodomegalias e metástases a distância. Com relação à localização, as lesões foram classificadas de acordo com o segmento gástrico de origem. Os contornos foram classificados como regulares, lobulados ou irregulares, e os limites foram descritos como bem definidos, mal definidos ou invasivos. A morfologia da lesão foi definida como redonda, ovalada ou irregular. O padrão de realce pelo meio de contraste venoso foi descrito como homogêneo ou heterogêneo, e a intensidade do realce foi comparada à densidade hepática e dos músculos abdominais e descrita como: realce discreto, se a densidade era igual ou inferior à do músculo; realce moderado, se a densidade era superior à do músculo e inferior ou igual à do fígado; e realce acentuado, se a densidade era superior à do fígado. O padrão de crescimento foi classificado de acordo com o componente predominante: intra ou extraluminal. Os casos que apresentavam os dois componentes, não sendo nenhum deles predominante, foram classificados como intra/extraluminal. As dimensões das lesões foram aferidas mediante mensuração das maiores medidas nos planos ortogonais. A avaliação histopatológica revelou que 12 pacientes (85,7%) apresentavam tumores com células fusiformes, um (7,2%) com células epitelióides e um (7,2%) com células mistas. Todos os casos possuíam confirmação imuno-histoquímica com positividade para c-Kit. Todos os pacientes foram submetidos aos seguintes tratamentos cirúrgicos: ressecção segmentar do estômago em oito casos (57,1%), gastrectomia total em quatro (28,6%) e gastrectomia subtotal em dois (14,3%). Três pacientes (21,4%) realizaram tratamento complementar com mesilato de imatinib. O estudo foi aprovado pelo Comitê de Ética em Pesquisas com Seres Humanos de nossa instituição.
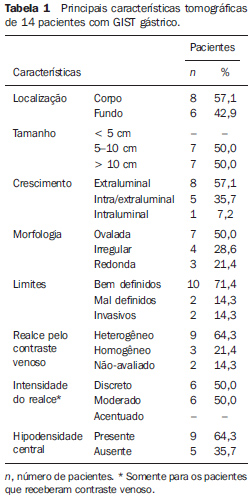
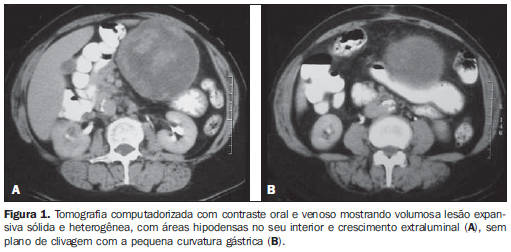
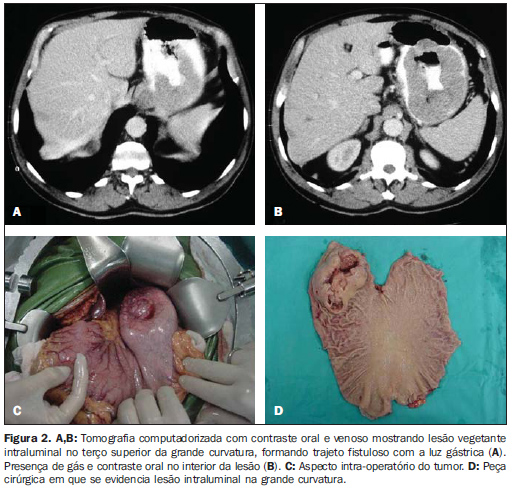
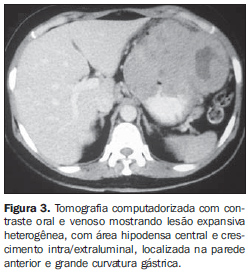
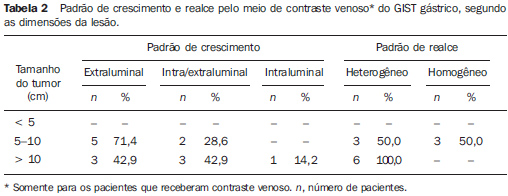
RESULTADOS As principais características tomográficas encontradas nos 14 pacientes com GIST gástrico são mostradas na Tabela 1. Os tumores estavam localizados no corpo (n = 8; 57,1%) ou no fundo gástrico (n = 6; 42,9%). As dimensões das lesões variaram de 6,0 a 23,0 cm, com tamanho médio de 11,5 ± 4,4 cm (média ± desvio-padrão). O crescimento da lesão foi predominantemente extraluminal em oito casos (57,1%) (Figura 1), intraluminal em um (7,2%) (Figura 2) e intra/extraluminal em cinco (35,7%) (Figura 3).
As lesões com crescimento extraluminal apresentaram dimensões entre 5,0 e 10,0 cm em cinco casos e maior que 10,0 cm em três casos, com tamanho médio de 11,4 ± 5,1 cm (Tabela 2). As lesões com crescimento intra/extraluminal apresentaram dimensões entre 5,0 e 10,0 cm em dois casos e maior que 10 cm em três casos, com média de 11,5 ± 4,1 cm. A única lesão intraluminal media 11,5 cm (Figura 2). Nenhum paciente apresentou tumor menor que 5,0 cm.
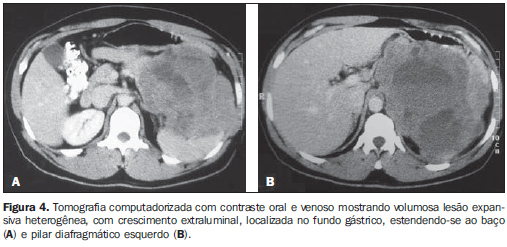
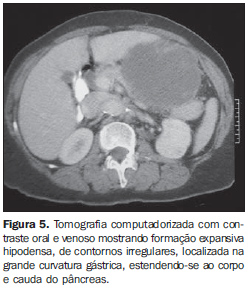
Com relação ao realce pelo meio de contraste venoso, nove pacientes (64,3%) mostraram realce heterogêneo e três (21,4%), realce homogêneo. Em dois pacientes (14,3%) não foi utilizado contraste venoso. Entre os que receberam contraste, o realce foi discreto em seis casos (50%) e moderado em seis (50%). Nenhum caso apresentou realce acentuado. Entre os tumores com dimensões de 5 a 10 cm, 50% apresentaram realce heterogêneo e 50%, realce homogêneo. Todos os tumores maiores que 10 cm apresentaram realce heterogêneo (Tabela 2). Os tumores heterogêneos apresentaram tamanho médio de 12,9 ± 4,6 cm, enquanto os tumores homogêneos apresentaram tamanho médio de 8,4 ± 1,1 cm. A maioria dos pacientes apresentou, ainda, lesão tumoral de orfologia ovalada (50%), contornos regulares (71,4%) e limites bem definidos (71,4%). Foi observada área de hipodensidade central em nove casos (64,3%), ulceração em seis (42,9%), fístula em quatro (28,6%), infiltração da gordura mesentérica em quatro (28,6%) e calcificação intratumoral em dois (14,3%). Linfonodomegalias adjacentes foram observadas em apenas um paciente (7,2%). A invasão de órgãos adjacentes foi observada em seis casos (42,9%), sendo o diafragma (n = 3; 21,4%), o baço (n = 2; 14,3%) e o pâncreas (n = 2; 14,3%) os mais afetados (Figuras 4 e 5).
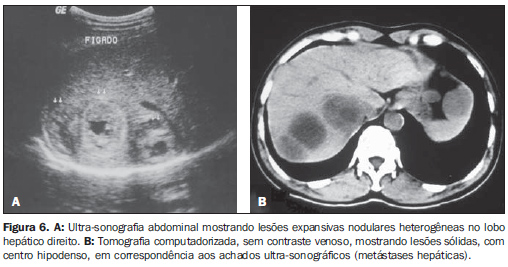
Em apenas um caso (7,2%) foram identificadas metástases hepáticas (Figura 6).
DISCUSSÃO Embora seja tumor incomum, o GIST é a neoplasia mesenquimal mais freqüente do trato digestivo, representando 1% a 3% de todos os tumores gastrintestinais e 2,5% dos tumores gástricos(10). O estômago é o sítio mais comum da doença, respondendo por cerca de 45% a 65% dos casos, seguido do delgado em 15% a 25%(2). Outros sítios mais raros correspondem ao reto, cólon, esôfago, apêndice, mesentério, omento, retroperitônio e outros locais não-relacionados ao trato gastrintestinal(11). A doença é mais comum em indivíduos acima de 50 anos, com média de idade entre 55 e 67 anos(9,12), sendo rara em pacientes abaixo de 40 anos(11). Nenhuma associação entre localização geográfica, etnia, raça ou ocupação tem sido estabelecida. Alguns autores relatam, ainda, ligeiro predomínio no sexo masculino(13) e aumento da incidência da doença em pacientes com neurofibromatose tipo 1(14). Nossa casuística constou de nove pacientes do sexo feminino (64,3%) e cinco do sexo masculino (35,7%). A média de idade foi de 59,4 anos. As manifestações clínicas em pacientes com GIST são inespecíficas e dependem do sítio da lesão. Hemorragia digestiva é o sintoma mais comum, que pode se expressar na forma de hematêmese, melena, hematoquezia ou sinais de anemia por sangramento oculto(9-11,15,16). Outras manifestações comuns são dor abdominal inespecífica, distensão abdominal, disfagia, emagrecimento, náuseas, vômitos, massa abdominal ou sintomas obstrutivos. Aproximadamente 20% dos casos podem ser lesões assintomáticas diagnosticadas durante avaliação por imagem ou durante procedimentos cirúrgicos(2,11). Em nossa casuística, dor abdominal foi o sintoma mais freqüente. Os tumores mesenquimais podem ser classificados pelas características à microscopia óptica e imuno-histoquímica. A classificação histopatológica é baseada no tipo celular predominante: células fusiformes, epitelióide ou misto(17). Os GISTs gástricos costumam se caracterizar por células fusiformes em 70% a 80% dos casos. O diagnóstico é feito por avaliação imuno-histoquímica, que se baseia na expressão da proteína KIT (CD117), codificada pelo proto-oncogene c-Kit (receptor de membrana com atividade tirosina quinase). Os GISTs são tumores CD117 positivos (95%) e CD34 positivos (30% a 40%)(17). Muitos estudos têm demonstrado que cerca de 4% dos casos apresentam características clínicas e patológicas compatíveis com GIST, mas não expressam a proteína KIT. Heinrich et al.(18) mostraram que este grupo apresenta mutação em outro receptor tirosina quinase com atividade semelhante ao KIT (receptor do fator de crescimento ativado plaquetário - PDGFRA), representando uma via alternativa na patogênese desta neoplasia. O diagnóstico diferencial inclui também outras neoplasias mesenquimais com perfil imuno-histoquímico diferente, como o leiomioma, o leiomiossarcoma, o schwannoma, os neurofibromas e os tumores neuroendócrinos(11,16). No presente estudo, a maioria dos pacientes apresentava tumor com células fusiformes (85,7%), enquanto os tumores com células epitelióides (7,2%) ou mistas (7,2%) foram menos freqüentes. Muitos fatores são identificados na literatura como variáveis capazes de predizer a evolução do GIST: tamanho, índice mitótico, presença de necrose tumoral, marcadores de proliferação celular, sítio do tumor(19). Os achados, no entanto, são conflitantes e não existe consenso, o que torna problemática a predição do comportamento biológico do tumor. Diante disto, tem-se evitado os termos "benigno" ou "maligno", classificando-se o GIST de acordo com o potencial de malignidade com base nos fatores prognósticos mais relevantes reconhecidos na literatura (sítio do tumor, tamanho e índice mitótico)(20). Os tumores gástricos podem então ser classificados como de alto risco, risco intermediário, baixo risco ou muito baixo risco. Considera-se o tumor como de alto risco se for maior que 10 cm, se apresentar mais de 10 mitoses por 50 campos de grande aumento (50 CGA), ou ainda se maior que 5 cm com mais de 5 mitoses por 50 CGA; risco intermediário se menor que 5 cm com 6 a 10 mitoses por 50 CGA ou se medir 5 a 10 cm com menos de 5 mitoses por 50 CGA; baixo risco se medir entre 2 e 5 cm com menos de 5 mitoses por 50 CGA; muito baixo risco se medir menos de 2 cm com menos de 5 mitoses por 50 CGA(2,17). As características tomográficas dos GISTs têm sido estudadas por vários autores(9-12,15,16,21-27). Sandrasegaran et al.(10) encontraram tumores medindo entre 3 e 10 cm, com crescimento predominantemente exofítico e realce heterogêneo pelo meio de contraste venoso. Levy et al.(11) encontraram lesões com dimensões bastante variadas, que se apresentavam como massas tipicamente circunscritas, algumas com áreas focais de hemorragia, degeneração cística e necrose. Na literatura revisada, o corpo gástrico foi o segmento mais acometido pelo GIST (38% a 75%)(11,15,16), com tamanho médio variando de 5,4 a 13,0 cm(22,26). No presente estudo, os tumores gástricos situavam-se predominantemente no corpo gástrico (57,1%) e apresentavam tamanho médio de 11,5 cm. Os tumores menores que 5 cm apresentam crescimento intraluminal e realce homogêneo pelo contraste venoso, enquanto os tumores maiores que 10 cm apresentam componente extraluminal e realce heterogêneo na maioria dos casos(9,15,23). Kim et al.(15) encontraram 57% dos tumores gástricos extraluminais com dimensões maiores que 10 cm e 89% dos tumores intraluminais menores que 5 cm. Da Ronch et al.(23), por outro lado, observaram 100% dos tumores maiores que 5 cm com crescimento extraluminal, sendo que o padrão de crescimento intraluminal estava mais relacionado a pequenas lesões. Resultados semelhantes foram relatados por Tateishi et al.(9), que observaram maiores dimensões nas lesões com crescimento extrínseco, sendo 91,3% delas acima do tamanho médio. Em nossa casuística, não foram encontrados tumores menores que 5 cm e apenas um paciente tinha lesão com crescimento intraluminal. No entanto, entre os que apresentaram tumores medindo entre 5 e 10 cm ou maiores que 10 cm, houve predomínio de lesões com crescimento extraluminal em 71,4% e 50%, respectivamente. O padrão de realce pelo meio de contraste também varia conforme as dimensões das lesões(15,24,26,27). No estudo de Kim et al.(15), 49% dos tumores heterogêneos eram maiores que 10 cm e 77% dos tumores homogêneos eram menores que 5 cm. Lee et al.(26) encontraram tamanho médio de 11,6 cm entre os tumores heterogêneos e 3,8 cm entre os tumores com realce homogêneo. Resultados semelhantes também foram descritos por Horton et al.(24) e Nishida et al.(27). No presente estudo, encontramos 66,7% dos tumores heterogêneos maiores que 10 cm e 100% dos tumores homogêneos medindo entre 5 e 10 cm. Além do realce heterogêneo pelo meio de contraste, os tumores grandes podem apresentar ulceração da mucosa, cavitação e áreas de hipodensidade central que podem corresponder a degeneração cística, hemorragia ou necrose. As cavidades necróticas podem também se comunicar com a luz do trato gastrintestinal e formar fístulas que contêm ar, nível hidroaéreo ou contraste oral(25). No presente estudo encontramos área de hipodensidade central em 64,3% dos pacientes, enquanto outros autores referem este achado em 20% a 49% dos casos(12,15). A presença de gás ou contraste no interior da lesão pode sugerir, também, a presença de ulceração da mucosa com formação de fístula. Outros trabalhos referem ulcerações em 3% a 88% dos casos, a maioria deles com alto grau histológico(9,12,13,15,16). Em nossa casuística, encontramos sinais de ulceração da mucosa em 42,9% dos pacientes e fístula em 28,6%. Fígado e peritônio são os sítios mais habituais de metástases do GIST, que podem ocorrer em até 38% dos casos(12). Outros sítios menos comuns são pulmão, mesentério, omento, ovário e bexiga(12). As metástases hepáticas podem apresentar-se, na tomografia computadorizada, como lesões hipodensas, lesões isodensas na fase portal com realce intenso na fase arterial, ou lesões císticas com densidade de partes moles na periferia(15). Os implantes podem tornar-se hipovasculares ou císticos após a quimioterapia, e este padrão não deve ser confundido com progressão da doença ou novas lesões(10,12). Em nosso estudo, apenas um paciente (7,2%) apresentou metástase hepática na apresentação da doença e seis pacientes (42,9%) apresentaram invasão de órgãos adjacentes, com acometimento predominante do diafragma, baço e pâncreas. A tomografia computadorizada ainda constitui o método de imagem de escolha na caracterização do GIST, bem como na avaliação do comprometimento de órgãos adjacentes, metástases abdominais e resposta ao tratamento(1). A introdução de novas tecnologias ao método, especialmente com a utilização de multidetectores e reconstruções multiplanares, tem permitido melhor avaliação dos grandes tumores exofíticos e das relações da lesão gástrica com as estruturas adjacentes, além de permitir a caracterização dos tumores em circunstâncias específicas, como massas de origem desconhecida ou originadas de locais de difícil acesso à endoscopia(23,25). Para a avaliação de resposta ao tratamento quimioterápico, parâmetros como hipoatenuação progressiva da massa, diminuição do realce nodular e da vascularização são indicativos de boa reposta(28). A ressecção cirúrgica completa é o tratamento padrão para o GIST, pois é a única modalidade terapêutica capaz de proporcionar a cura da doença, embora cerca de 20% a 50% dos pacientes submetidos à ressecção completa apresentem recorrência(29). A taxa de sobrevida em cinco anos após ressecção completa do GIST varia entre 30% e 65%(29). Nos casos de tumores inoperáveis ou metastáticos, o tratamento de escolha é realizado com mesilato de imatinib (STI 571), um inibidor seletivo da enzima tirosina quinase, que tem sido utilizado como terapia adjuvante ou neoadjuvante diante de tumores de grandes dimensões, inicialmente irressecáveis, ou nos casos em que a cirurgia impossibilita a ressecção completa(28). Muitos autores sugerem que a involução da doença pode ocorrer, permitindo a ressecção de tumores previamente não-operáveis(30). Estudos recentes têm demonstrado que o imatinib apresenta atividade significativa nos doentes com GIST avançado, alcançando taxa de resposta parcial em 53,7% e estabilização da doença em 27,9%(8). Na nossa casuística todos os pacientes realizaram tratamento cirúrgico, na maioria dos casos ressecção gástrica segmentar (57,1%), e três pacientes (21,4%) foram submetidos também ao tratamento com mesilato de imatinib.
CONCLUSÃO No presente estudo, a maioria dos GISTs gástricos localizava-se no corpo gástrico, com tamanho médio de 11,5 cm, apresentando área hipodensa central, realce heterogêneo pelo meio de contraste e crescimento predominantemente extraluminal. O conhecimento dos aspectos típicos e das variações tomográficas desta neoplasia em sua localização mais comum permite ao radiologista estabelecer o diagnóstico diferencial dos tumores gástricos, bem como orientar as etapas subseqüentes da investigação diagnóstica e auxiliar no planejamento terapêutico.
REFERÊNCIAS 1. Blay JY, Bonvalot S, Casali P, et al. Consensus meeting for the management of gastrointestinal stromal tumors. Report of the GIST Consensus Conference of 20-21 March 2004, under the auspices of ESMO. Ann Oncol. 2005;16:566-78. [ ] 2. Efron DT, Lillemoe KD. The current management of gastrointestinal stromal tumors. Adv Surg. 2005;39:193-221. [ ] 3. Mazur MT, Clark HB. Gastric stromal tumors. Reappraisal of histogenesis. Am J Surg Pathol. 1983;7:507-19. [ ] 4. Lauwers GY, Erlandson RA, Casper ES, et al. Gastrointestinal autonomic nerve tumors. A clinicopathological, immunohistochemical, and ultrastructural study of 12 cases. Am J Surg Pathol. 1993;17:887-97. [ ] 5. Kindblom LG, Remotti HE, Aldenborg F, et al. Gastrointestinal pacemaker cell tumor (GIPACT): gastrointestinal stromal tumors show phenotypic characteristics of the interstitial cells of Cajal. Am J Pathol. 1998;152:1259-69. [ ] 6. Hirota S, Isozaki K, Moriyama Y, et al. Gain-of-function mutations of c-kit in human gastrointestinal stromal tumors. Science. 1998;279:577-80. [ ] 7. Huizinga JD, Thuneberg L, Klüppel M, et al. W/kit gene required for interstitial cells of Cajal and for intestinal pacemaker activity. Nature. 1995; 373:347-9. [ ] 8. Demetri GD, von Mehren M, Blanke CD, et al. Efficacy and safety of imatinib mesylate in advanced gastrointestinal stromal tumors. N Engl J Med. 2002;347:472-80. [ ] 9. Tateishi U, Hasegawa T, Satake M, et al. Gastrointestinal stromal tumor. Correlation of computed tomography findings with tumor grade and mortality. J Comput Assist Tomogr. 2003;27: 792-8. [ ] 10. Sandrasegaran K, Rajesh A, Rydberg J, et al. Gastrointestinal stromal tumors: clinical, radiologic, and pathologic features. AJR Am J Roentgenol. 2005;184:803-11. [ ] 11. Levy AD, Remotti HE, Thompson WM, et al. Gastrointestinal stromal tumors: radiologic features with pathologic correlation. Radiographics. 2003;23:283-304. [ ] 12. Sandrasegaran K, Rajesh A, Rushing DA, et al. Gastrointestinal stromal tumors: CT and MRI findings. Eur Radiol. 2005;15:1407-14. [ ] 13. Ghanem N, Altehoefer C, Furtwängler A, et al. Computed tomography in gastrointestinal stromal tumors. Eur Radiol. 2003;13:1669-78. [ ] 14. Boldorini R, Tosoni A, Leutner M, et al. Multiple small intestinal stromal tumours in a patient with previously unrecognized neurofibromatosis type 1: immunohistochemical and ultrastructural evaluation. Pathology. 2001;33:390-5. [ ] 15. Kim HC, Lee JM, Kim KW, et al. Gastrointestinal stromal tumors of the stomach: CT findings and prediction of malignancy. AJR Am J Roentgenol. 2004;183:893-8. [ ] 16. Martín-Lorenzo JG, Aguayo-Albasini JL, Torralba-Martínez JA, et al. Gastrointestinal stromal tumors. Diagnosis, prognosis and current surgical treatment. Follow-up of 18 treated patients. Cir Esp. 2006;79:22-7. [ ] 17. Fletcher CD, Berman JJ, Corless C, et al. Diagnosis of gastrointestinal stromal tumors: a consensus approach. Hum Pathol. 2002;33:459-65. [ ] 18. Heinrich MC, Corless CL, Duensing A, et al. PDGFRA activating mutations in gastrointestinal stromal tumors. Science. 2003;299:708-10. [ ] 19. Fujimoto Y, Nakanishi Y, Yoshimura K, et al. Clinicopathologic study of primary malignant gastrointestinal stromal tumor of the stomach, with special reference to prognostic factors: analysis of results in 140 surgically resected patients. Gastric Cancer. 2003;6:39-48. [ ] 20. Miettinen M, El-Rifai W, Sobin LH, et al. Evaluation of malignancy and prognosis of gastrointestinal stromal tumors: a review. Hum Pathol. 2002;33:478-83. [ ] 21. Buckley JA, Fishman EK. CT evaluation of small bowel neoplasms: spectrum of disease. Radiographics. 1998;18:379-92. [ ] 22. Burkill GJC, Badran M, Al-Muderis O, et al. Malignant gastrointestinal stromal tumor: distribution, imaging features, and pattern of metastatic spread. Radiology. 2003;226:527-32. [ ] 23. Da Ronch T, Modesto A, Bazzocchi M. Gastrointestinal stromal tumour: spiral computed tomography features and pathologic correlation. Radiol Med (Torino). 2006;111:661-73. [ ] 24. Horton KM, Juluru K, Montogomery E, et al. Computed tomography imaging of gastrointestinal stromal tumors with pathology correlation. J Comput Assist Tomogr. 2004;28:811-7. [ ] 25. Lau S, Tam KF, Kam CK, et al. Imaging of gastrointestinal stromal tumour (GIST). Clin Radiol. 2004;59:487-98. [ ] 26. Lee CM, Chen HC, Leung TK, et al. Gastrointestinal stromal tumor: computed tomographic features. World J Gastroenterol. 2004;10:2417-8. [ ] 27. Nishida T, Kumano S, Sugiura T, et al. Multi-detector CT of high-risk patients with occult gastrointestinal stromal tumors. AJR Am J Roentgenol. 2003;180:185-9. [ ] 28. Cormier JN, Patel SR, Pisters PW. Gastrointestinal stromal tumors: rationale for surgical adjuvant trials with imatinib. Curr Oncol Rep. 2002;4: 504-9. [ ] 29. DeMatteo RP, Lewis JJ, Leung D, et al. Two hundred gastrointestinal stromal tumors: recurrence patterns and prognostic factors for survival. Ann Surg. 2000;231:51-8. [ ] 30. Scaife CL, Hunt KK, Patel SR, et al. Is there a role for surgery in patients with "unresectable" cKIT+ gastrointestinal stromal tumors treated with imatinib mesylate? Am J Surg. 2003;186:665-9. [ ]
Recebido para publicação em 23/9/2007. Aceito, após revisão, em 7/2/2008.
* Trabalho realizado no Hospital do Câncer I, Instituto Nacional de Câncer (INCA), Rio de Janeiro, RJ, Brasil. |
|
Av. Paulista, 37 - 7° andar - Conj. 71 - CEP 01311-902 - São Paulo - SP - Brazil - Phone: (11) 3372-4544 - Fax: (11) 3372-4554