Radiologia Brasileira - Publicação Científica Oficial do Colégio Brasileiro de Radiologia
AMB - Associação Médica Brasileira CNA - Comissão Nacional de Acreditação
 Vol. 37 nº 2 - Mar. / Abr. of 2004
Vol. 37 nº 2 - Mar. / Abr. of 2004
|
ARTIGO ORIGINAL
|
|
|
|
|
Autho(rs): Leonardo Vedolin, Edson Marchiori, Carlos Rieder |
|
|
Descritores: Doença de Parkinson, Resonância magnética, Neurorradiologia |
|
|
Resumo: IIIDoutor em Neurologia pela Universidade de Birmingham (Reino Unido), Coordenador do Ambulatório de Distúrbios do Movimento do HCPA
Introdução A doença de Parkinson (DP) é uma das doenças neurodegenerativas crônicas mais comuns nos idosos. Clinicamente, caracteriza-se por tremor de repouso, rigidez, bradicinesia, instabilidade postural e distúrbios da marcha(1,2). Devido à alta prevalência, custo do tratamento e o importante impacto social, diversos estudos têm sido realizados para o diagnóstico da doença(3-11). Apesar dos sintomas clássicos, o diagnóstico clínico da DP não é específico(2). Além disso, não há exames laboratoriais diagnósticos e existem outras doenças que se manifestam com parkinsonismo e simulam clinicamente a DP, como a atrofia de múltiplos sistemas (AMS) e a paralisia supranuclear progressiva (PSP)(12). Por outro lado, a existência de novas terapias farmacológicas e novas opções de tratamento cirúrgico tornaram fundamentais o diagnóstico preciso dessas doenças(13). Devido à dificuldade em estabelecer o diagnóstico das síndromes parkinsonianas, outros testes têm sido explorados, como a resposta terapêutica a agentes dopaminérgicos, eletroneuromiografia esfincteriana, testes de função olfatória, testes neuropsicológicos, marcadores bioquímicos e genéticos, e métodos de imagem(4-11,14-16). Atualmente, os métodos de imagem mais sensíveis para a detecção de DP são a tomografia por emissão de pósitrons (PET) e a tomografia computadorizada por emissão de fóton único (SPECT)(17,18). O PET mede o metabolismo da dopamina no corpo estriado e o SPECT utiliza um traçador, que é sensível para transportadores de dopamina. Estes, entretanto, são métodos que exigem um tempo longo de exame, apresentam alto custo e são pouco disponíveis no nosso meio. A ressonância magnética (RM), por outro lado, é um método relativamente simples, acessível e de menor custo em relação a outros métodos funcionais. Diversos estudos demonstraram o papel do método no diagnóstico da doença(4-11). Vários achados têm sido descritos, como a redução da espessura da pars compacta (PC) no mesencéfalo, atrofia cerebral e alterações nos metabólitos cerebrais na espectroscopia por RM(4-11,18-21). Os resultados dos estudos da DP, entretanto, têm sido divergentes. Alguns autores descreveram que a redução da espessura da PC é um sinal específico de DP(6,7), enquanto outros discordam(22,23). Da mesma forma, diferentes resultados têm sido encontrados na análise da atrofia cerebral, na intensidade de sinal no putâmen, nas lesões mesencefálicas e nas alterações da substância branca cerebral(4,8,10,23). O objetivo do trabalho foi avaliar o papel da RM no diagnóstico da DP e na diferenciação das síndromes parkinsonianas.
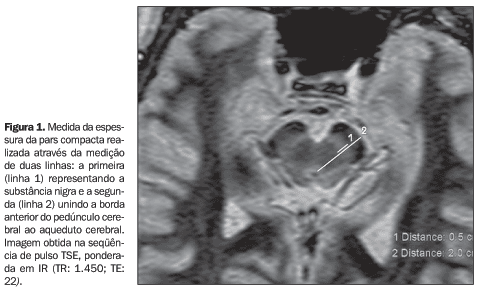
MATERIAIS E MÉTODOS De outubro de 1999 a outubro de 2002, foi realizado um estudo observacional, prospectivo, caso-controle, avaliando-se, por meio da RM, 42 pacientes com sintomas parkinsonianos, provenientes dos ambulatórios de distúrbios do movimento dos Departamentos de Neurologia dos Hospitais São Lucas da PUC e Clínicas, em Porto Alegre, RS. Os pacientes foram avaliados clinicamente por dois neurologistas, especialistas em distúrbios do movimento, e divididos em dois grupos, de acordo com o diagnóstico clínico estabelecido. No grupo 1 foram incluídos pacientes com provável ou possível DP, utilizando os critérios clínicos de Gelb et al.(24). O grupo 2 foi composto por pacientes com síndromes parkinsonianas atípicas (SPA). Neste grupo, foram incluídos pacientes com diversas síndromes parkinsonianas, como AMS, degeneração córtico-gangliobasal (DCGB), parkinsonismo vascular e parkinsonismo induzido por drogas. Os resultados destes grupos foram comparados com um grupo controle (n = 18). O grupo controle foi formado por pacientes que realizaram RM por outras razões, exceto distúrbios do movimento. Foram excluídos deste grupo pacientes com sinais de lesão expansiva intracraniana, acidente cerebral vascular, exceto lacunar ou hidrocefalia. Os exames foram realizados em equipamentos de RM de 1,5 T (GE LX, General Electric, Milwaukee; Siemens Magneton Plus e Siemens Symphony, Erlang, Alemanha), utilizando as seqüências de pulso SE e TSE axiais, ponderadas em T2 (TR: 7.100; TE: 115; espessura do corte: 5 mm; FOV: 230; matriz: 345 × 512), FLAIR (TR: 9.000; TE: 110; espessura do corte: 5 mm; FOV: 230; matriz: 154 × 256) e IR (TR: 1.450, TE: 115, espessura do corte: 3 mm, FOV: 200; matriz: 160 × 256). As imagens foram obtidas para análise morfológica do mesencéfalo, núcleos da base e substância branca cerebral. Também foram obtidas imagens sagitais SE, ponderadas em T1 (TR: 580; TE: 14; espessura do corte: 5 mm; FOV: 260; matriz: 156 × 256). O tempo total médio dos exames foi de cerca de 30 minutos. Foram avaliadas as seguintes variáveis: espessura da PC do mesencéfalo, grau de hipointensidade de sinal no putâmen, grau de atrofia cerebral, lesões no mesencéfalo, lesões na substância branca e a presença de lesão na borda póstero-lateral do putâmen. A espessura da PC foi avaliada por meio de um índice, denominado índice da PC (IPC). Através do programa digital de medição do aparelho de RM, traçaram-se duas linhas verticais no mesencéfalo, utilizando a seqüência de pulso IR no plano axial. A primeira (linha 1) foi mensurada da borda anterior à borda posterior da faixa de hipersinal, que representa a dimensão da substância nigra (DSN), e a segunda (linha 2) unindo a borda anterior do pedúnculo cerebral ao aqueduto cerebral (dimensão pedúnculo-aquedutal - DPA). Foi estabelecido um índice, IPC, entre a DSN e a DPA (IPC = DSN/DPA). Estas medidas foram realizadas nos lados esquerdo (IPCE) e direito (IPCD) do mesencéfalo, e um índice final (IFPC) foi calculado (IPCF = IPCE + IPCD/2). Estas medidas foram sempre realizadas no plano axial, utilizando a seqüência de pulso IR. O grau de atrofia cerebral foi mensurado segundo o método descrito por Meese et al.(25). Foram traçadas duas linhas transversais no plano axial do encéfalo, na seqüência de pulso TSE, ponderada em T2. A primeira, medindo a diâmetro látero-lateral dos ventrículos laterais (D1), e a segunda, entre os ossos parietais (D2). O índice de atrofia cerebral (IAC) foi estabelecido pela fórmula IAC: 10 - (D2/D1). Foram estabelecidos três graus de hipointensidade de sinal no putâmen, utilizando a seqüência de pulso TSE, ponderada em FLAIR, conforme a extensão do hipossinal no interior do núcleo: grau I (perda de sinal menor que 25% da área do núcleo); grau II (perda entre 25-50%) e grau III (perda maior que 50%). A lesão na borda do putâmen foi descrita por Kraft et al.(8), como uma região linear que apresenta hipersinal em T2, localizada na metade posterior e lateral do putâmen. Foram estabelecidos quatro graus de lesões na substância branca: ausente (grau 0), leve (grau 1), moderada (grau 2) e grave (grau 3). Esta análise foi realizada no plano axial, utilizando a seqüência de pulso ponderada em FLAIR. A presença ou ausência de lesões no mesencéfalo foi avaliada nas imagens axiais do encéfalo, utilizando a seqüência de pulso TSE, ponderada em T2. Para a análise estatística dos dados foi utilizado o programa SPSS. Os resultados foram considerados significativos quando p < 0,05.
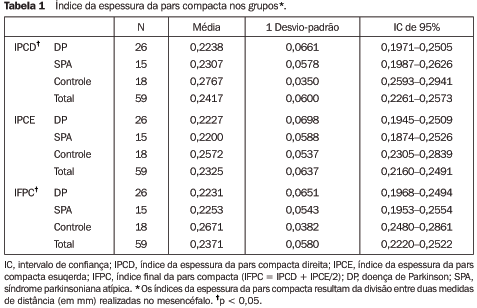
RESULTADOS Dos 42 pacientes com sintomas parkinsonianos estudados por RM, 26 preencheram critérios para DP e 16 para SPA. O grupo controle foi composto por 18 pacientes. No grupo de pacientes com DP, 14 eram do sexo masculino e 12, do sexo feminino. Nos pacientes com SPA, sete eram homens e nove, mulheres. O grupo controle foi composto por sete homens e 11 mulheres. Em relação ao sexo, não houve diferenças significativas entre os grupos (p = 0,597). A média de idade foi de 58,2 anos nos grupos DP e controle, e de 60,5 anos no grupo SPA. Estas diferenças não foram estatisticamente significativas (p = 0,883). Espessura da pars compacta Os resultados da espessura da PC, expressos pelos índices da espessura da PC direita (IPCD), esquerda (IPCE) e final (IFPC), nos três grupos, estão demonstrados na Tabela 1.
Os pacientes do grupo DP apresentaram redução do IPCD e IFPC, quando comparados com o grupo controle (p = 0,0092 e 0,0326, respectivamente). O mesmo resultado foi observado na comparação dos grupos SPA e controle (p = 0,0581 e 0,0885, respectivamente para IPCD e IFPC). Não se observaram diferenças entre os grupos DP e SPA, nas três medidas obtidas (p > 0,05), e entre os três grupos em relação ao IPCE (p > 0,05). Na análise de variâncias, não se observou relação entre a redução da espessura da PC, idade dos pacientes e grau de atrofia cerebral (p > 0,05). Em relação ao grau de hipointensidade de sinal no putâmen, observou-se que o IFPC foi menor (0,20) nos pacientes com grau III de hipointensidade no putâmen do que naqueles com graus I e II (0,25; p = 0,01). Exemplo da avaliação da espessura da PC é demonstrado na Figura 1.
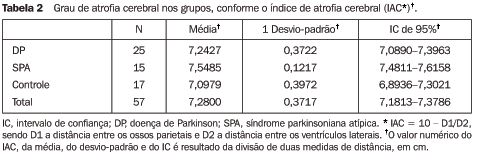
Grau de atrofia cerebral Os pacientes do grupo SPA apresentaram maior grau de atrofia cerebral, quando comparados com os grupos DP e controle, sendo que estas diferenças foram estatisticamente significativas (p = 0,019 e 0,001, respectivamente). A média da atrofia cerebral foi semelhante entre os grupos DP e controle (p = 0,361). A análise de variância mostrou que a idade e os índices da espessura da PC não influenciaram os resultados obtidos nos grupos (p > 0,05). Os dados, em relação ao grau de atrofia cerebral nos grupos, estão na Tabela 2.
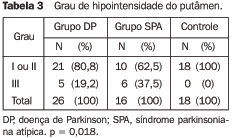
Grau de hipointensidade de sinal no putâmen Os pacientes dos grupos DP e SPA apresentaram maiores graus de hipointensidade de sinal no putâmen, quando comparados com o grupo controle, sendo que, no grupo SPA, esta diferença foi estatisticamente significativa (p = 0,018). Do total, 37,5% dos pacientes com SPA apresentam grau III de hipointensidade, comparado com somente 19,2% daqueles com DP. Nenhum paciente do grupo controle teve grau de hipointensidade de sinal maior que II. A Tabela 3 descreve estes dados.
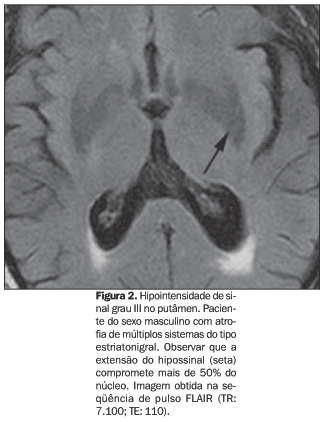
Apesar de os pacientes mais idosos terem tido maiores graus de hipossinal no putâmen, esta diferença não atingiu significância estatística (p > 0,05). Todos os pacientes com AMS do tipo estriato-nigral apresentavam grau de hipointensidade de sinal maior ou igual a II, sendo que 50% (3/6) tiveram grau III (Figura 2).
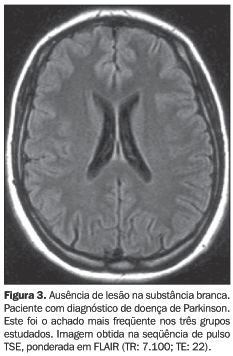
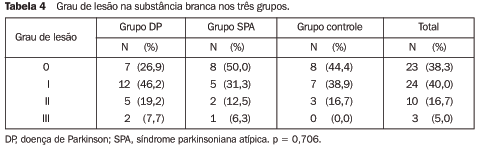
Lesões na substância branca Em relação às lesões na substância branca, a grande maioria dos pacientes (78,3%) apresentou lesões menores do que grau I (73,1% dos pacientes do grupo DP, 81,3% do grupo SPA e 83,3% do grupo controle) (Figura 3). Do total, três pacientes apresentaram grau III de lesões na substância branca. Destes, dois pertenciam ao grupo DP e um ao grupo SPA. Nenhum paciente do grupo controle apresentou grau de lesão maior que II. Não houve diferenças estatisticamente significativas entre os grupos (p > 0,05). Os dados sobre o grau de lesões na substância branca são apresentados na Tabela 4.
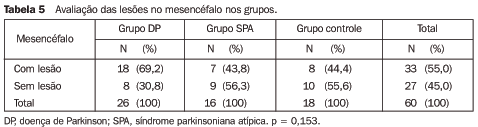
Um dado interessante na amostra estudada foi que todos os pacientes com lesões grau III na substância branca tiveram hipointensidade de sinal maior que 50% (graus II ou III) no putâmen. Em relação à idade, observou-se que os pacientes mais idosos, independentemente do grupo ao qual pertenciam, apresentaram maior grau de lesões na substância branca (p < 0,05). Dos quatro pacientes com parkinsonismo vascular, somente um deles apresentou lesões grau III na substância branca. Lesões no mesencéfalo As lesões no mesencéfalo foram um achado freqüente na população estudada. Dos 60 pacientes avaliados, 33 (55%) apresentaram este tipo de alteração na RM. A prevalência foi maior no grupo de pacientes com DP (69,2%) do que nos pacientes com SPA (43,8%) e no grupo controle (44,4%). Estas diferenças não foram estatisticamente significativas (p = 0,153), independentemente da idade dos pacientes (Tabela 5).
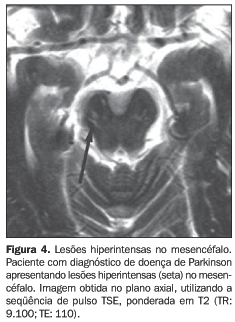
Dos pacientes com SPA, este tipo de lesão ocorreu em dois pacientes com parkinsonismo vascular (2/4), dois com AMS (2/6), dois com parkinsonismo não-responsivo à levodopa (2/2) e um paciente com diagnóstico de DCGB (1/2). A Figura 4 mostra o exame de RM de um paciente com DP que apresentava lesões hiperintensas em T2, bilaterais, localizadas na região da base do mesencéfalo.
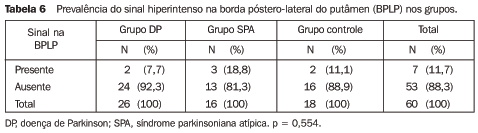
Sinal hiperintenso na borda póstero-lateral do putâmen A presença da lesão hiperintensa localizada na borda póstero-lateral do putâmen, na seqüência de pulso TSE ponderada em FLAIR, foi um achado pouco freqüente na amostra estudada (Tabela 6). Do total de pacientes estudados, somente 11,7% (7/60) apresentaram esta alteração (18,8% dos pacientes com SPA, 11,1% no grupo controle e 7,7% dos pacientes com DP). Não se observou diferença estatisticamente significativa entre os grupos.
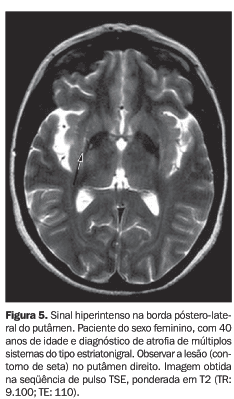
Um dado interessante foi que todos os pacientes do grupo SPA que apresentaram este sinal (3/3) tinham o diagnóstico de AMS do tipo estriatonigral (Figura 5). Por outro lado, apenas três pacientes (50%) de seis com o diagnóstico de AMS apresentaram este sinal (todos do tipo estriatonigral). O único paciente com o diagnóstico de AMS do tipo cerebelar não mostrava alterações de sinal no putâmen. A prevalência do sinal nos grupos ocorreu independentemente da idade dos pacientes.
DISCUSSÃO A DP representa uma das doenças neurodegenerativas mais comuns nos adultos(1,2). Ela caracteriza-se pela degeneração dos neurônios localizados na PC da substância nigra (SN) do mesencéfalo, e clinicamente manifesta-se por tremor de repouso, bradicinesia e rigidez(26). Por ser uma doença crônica, debilitante e progressiva, exige alto custo com medicamentos, assistência social e hospitalar, além de apresentar um impacto social significativo(3). Apesar de os sinais e sintomas serem clássicos, o diagnóstico da DP é difícil nas fases iniciais da doença(21). Existem várias doenças extrapiramidais que podem ser confundidas com a DP, como a AMS e a PSP. O diagnóstico diferencial entre as síndromes parkinsonianas é fundamental, pois o prognóstico e a resposta terapêutica destas doenças são variados. Diversos métodos diagnósticos têm sido estudados na DP(4-11,14-16). Entre eles, o mais utilizado é a resposta terapêutica aos agentes dopaminérgicos, satisfatória em pacientes com DP e insuficiente naqueles com síndromes parkinsonianas, especialmente na AMS. Este teste, entretanto, não é específico, pois muitos pacientes com AMS, em fase inicial, podem obter boa resposta terapêutica. Por outro lado, os métodos de imagem, particularmente o PET, o SPECT e a RM, evoluíram significativamente no diagnóstico da DP. Atualmente, o PET e o SPECT são os métodos mais sensíveis na detecção da doença. Ambos medem a função da dopamina no corpo estriado, que é o neurotransmissor envolvido na gênese da DP. Além do diagnóstico, estes métodos têm-se mostrado úteis no diagnóstico pré-clínico e na avaliação da progressão da doença(17,18). Eles, entretanto, são métodos caros, pouco acessíveis no nosso meio e que exigem um tempo longo de exame(7). A RM, por sua vez, tem sido empregada rotineiramente na avaliação de diversas doenças do sistema nervoso central. O método apresenta alta sensibilidade na detecção de lesões, excelente resolução espacial e capacidade de avaliação multiplanar. Este método é fundamental na avaliação de possíveis causas cirúrgicas de parkinsonismo, como tumor cerebral, hidrocefalia e hematoma intracraniano. Mais recentemente, diversos autores têm utilizado o método no diagnóstico diferencial das síndromes parkinsonianas(4-11). Os resultados dos estudos com RM, entretanto, têm sido divergentes. Como o local da degeneração neuronal na DP é a SN, a morfologia, as dimensões e a intensidade de sinal desta estrutura têm sido estudadas por meio da RM(4-9,11,22). Duguid et al.(6) e Braffman et al.(4) foram os primeiros a descrever uma redução da espessura da PC em pacientes com a DP. Por outro lado, alguns autores relatam que o diagnóstico diferencial das síndromes parkinsonianas não pode ser determinado através desta medida(11,22,27). Stern et al.(11) e Aotsuka et al.(27), por exemplo, relataram a redução da espessura da PC em pacientes com AMS. Neste estudo, avaliamos a SN do mesencéfalo utilizando a seqüência de pulso TSE, ponderada em IR e um índice (IPC) baseado na relação entre a banda de hipersinal correspondente à SN e o tamanho do mesencéfalo. A utilização desta seqüência de pulso foi descrita pela primeira vez por Hutchinson e Raff(7) e, mais recentemente, por Hu et al.(28). Na população estudada, observou-se que os pacientes com DP e SPA apresentaram redução da espessura da PC, quando comparados com o grupo controle. Esta redução ocorreu independentemente da idade dos pacientes ou grau de atrofia cerebral. Entretanto, esta redução não foi um achado específico para o diagnóstico de DP. Estes resultados são semelhantes àqueles descritos por Adachi et al.(22), Wakai et al.(26) e Bhattacharya et al.(23). Um achado interessante nesta amostra foi que as menores medidas da PC foram encontradas nos pacientes que tiveram grau III de hipointensidade de sinal no putâmen. Uma das explicações deste fenômeno pode ser a degeneração transneuronal que, eventualmente, poderia comprometer a SN e o putâmen. Este fenômeno foi descrito por Ogawa et al.(29) que concluíram, em seu estudo de 25 pacientes, que a degeneração da SN pode ocorrer em casos de infarto no corpo estriado. Dessa forma, os resultados obtidos nesta amostra de pacientes com parkinsonismo sugerem que a medida da espessura da PC pode indicar a presença de alguma síndrome parkinsoniana. Este sinal isolado, entretanto, não parece ser capaz de diferenciar a causa da doença extrapiramidal. A presença de lesões com sinal aumentado localizadas no mesencéfalo foi descrita em pacientes com DP e em outras síndromes parkinsonianas(4,10). No presente estudo, estas lesões foram encontradas na maioria dos pacientes com DP (69,2%), mas foram observadas também no grupo controle (44,4%) e nos pacientes com SPA (43,8%). Estas alterações ocorreram independentemente da idade dos pacientes. Dessa forma, a presença deste sinal não foi útil no diagnóstico diferencial das síndromes parkinsonianas. Existem algumas razões para a alta prevalência deste achado. Em primeiro lugar, a presença de áreas hiperintensas em T2 no mesencéfalo é comum em pessoas assintomáticas, devido à dilatação dos espaços perivasculares dos ramos pontinos da artéria basilar (espaços de Virchow-Robin). Estes espaços perivasculares se apresentam como imagens hiperintensas nas seqüências com TR longo (T2, por exemplo), mas permanecem isointensas ao líquor nas seqüências ponderadas em T1. Além disso, são comuns no mesencéfalo e, na maioria das vezes, representam uma variação anatômica(30). Ainda, áreas de isquemia ou desmielinização, mesmo subclínicas, também ocorrem nesta topografia e ambas se apresentam como regiões de hipersinal em T2. A alta prevalência dessas lesões no grupo controle deste estudo (44,4%) corroboram estes achados. Um tipo de lesão no mesencéfalo que não foi estudada nesta população, foram aquelas que comprometem os pedúnculos cerebelares superiores. Oka et al.(31) relataram que estas lesões são sugestivas de PSP. No nosso estudo, nenhum paciente com PSP foi analisado. Dessa forma, a utilidade deste sinal no diagnóstico diferencial da causa da síndrome parkinsoniana não foi estabelecida. Em relação ao putâmen, Milton et al.(32) descreveram que o envelhecimento normal determina perda da intensidade de sinal nos núcleos da base. Esta perda é progressiva e acomete mais precocemente o globo pálido, a pars reticulata do mesencéfalo e o núcleo denteado do cerebelo. Como discutido anteriormente, na DP a morte neuronal ocorre principalmente na PC do mesencéfalo. O putâmen pode ser afetado de forma indireta, através da disfunção da via nigroestriatal, mas a morte celular neste grupo neuronal não é comum em pacientes com DP. Por outro lado, na AMS, principalmente do tipo estriatonigral, o putâmen é a região mais precocemente acometida por morte celular e depósito anormal de ferro. Neste estudo, os pacientes com DP e SPA tiveram maiores graus de hipossinal no putâmen, quando comparados com o grupo controle. Esta diferença atingiu significância estatística, principalmente no grupo de pacientes com SPA. Analisando os resultados dos pacientes com SPA, observamos que 100% dos pacientes com AMS (6/6) apresentaram hipossinal maior ou igual ao grau II e 50% deles (3/6), maior ou igual a III. Em relação à DP, a maioria dos pacientes que apresentaram grau de hipossinal igual a 3 (3/5) tinha idade superior a 75 anos. Dessa forma, a presença de hipossinal no putâmen, comprometendo mais do que 50% do núcleo, sugere o diagnóstico de alguma síndrome parkinsoniana. Nos pacientes jovens, principalmente abaixo dos 50 anos, este sinal é indicativo de AMS. A presença de uma zona linear de hipersinal em T2 na borda póstero-lateral do putâmen tem sido descrita com freqüência em pacientes com AMS, principalmente do tipo estriatonigral(8,10,23). Neste estudo, este sinal foi um achado pouco freqüente. Somente sete pacientes (11,7%), dos 60 avaliados, apresentaram esta alteração. Entre os pacientes com SPA, todos os que apresentaram este sinal (3/3) tinham o diagnóstico de AMS do tipo estriatonigral. Por outro lado, apenas três pacientes (50%), do total de seis com o diagnóstico de AMS, apresentaram este sinal (todos do tipo estriatonigral). Estes resultados são semelhantes aos descritos por Bhattacharya et al.(23). Dessa forma, esta lesão é um sinal específico, mas pouco sensível para AMS, principalmente do tipo estriatonigral. A presença deste sinal em pacientes com DP pode ocorrer, mas é incomum. Nesta população, os pacientes com SPA apresentaram maiores graus de atrofia cerebral, independentemente da idade, espessura da PC e grau de lesões na substância branca dos pacientes. Ao contrário das conclusões do estudo de Braffman et al.(4), o mesmo resultado não ocorreu nos pacientes com DP. Uma das razões para a maior prevalência de atrofia nos pacientes pode ter sido a presença de pacientes com DCGB e AMS. Com se sabe, a prevalência de atrofia cerebral nestas doenças é maior(33,34). A presença de lesões na substância branca, hiperintensas nas seqüências de pulso ponderadas em T2 e FLAIR, tem sido descrita no envelhecimento normal e em diversas doenças, como isquemia, desmielinização e doenças degenerativas(4,30). Neste estudo, a prevalência de lesões moderadas ou graves foi pequena. Aproximadamente 78% dos pacientes estudados apresentaram lesões menores do que grau I. Dos 60 pacientes estudados, somente três apresentaram lesões grau III. Destes, dois pertenciam ao grupo DP e um ao grupo SPA. Nenhum paciente do grupo controle apresentou grau de lesão maior que II. Um dado interessante é que pacientes idosos tiveram maiores graus de lesões na substância branca, quando comparados com os pacientes mais jovens. Esta diferença foi estatisticamente significativa na população estudada. Este achado corrobora os resultados descritos por Drayer(35), de que a presença deste tipo de lesão aumenta com a idade do paciente e, patologicamente, reflete a presença de gliose, isquemia ou desmielinização tecidual. Ao contrário das conclusões descritas por Zijlmans et al.(36), não observamos diferenças no grau de lesões entre os pacientes com parkinsonismo vascular e aqueles com DP. Além da amostra pequena, é possível que o método utilizado neste estudo possa, pelo menos parcialmente, explicar as diferenças encontradas. Outro dado interessante é que todos os pacientes que tiveram lesões grau III apresentaram hipointensidade de sinal que comprometia mais do que 50% do volume do putâmen. Como uma das explicações para a alteração de sinal no putâmen são as seqüelas de lacunas isquêmicas, é possível que estas lesões estejam relacionadas com eventos isquêmicos na distribuição dos pequenos ramos perfurantes das artérias lentículo-estriadas. A principal limitação deste estudo é a falta de comprovação anatomopatológica dos casos, que pode ter sido um viés de seleção. Como o diagnóstico destas doenças ainda é clínico, esta característica não é exclusiva deste estudo, ocorrendo na maioria dos estudos realizados com síndromes parkinsonianas. Esta limitação pode ter sido minimizada, se levarmos em conta que os critérios clínicos utilizados no diagnóstico da DP seguiram os critérios de Gelb et al.(24). Além disso, todos os pacientes foram avaliados por dois neurologistas especialistas em distúrbios do movimento. Em conclusão, a RM detectou alterações morfológicas cerebrais que auxiliam no diagnóstico diferencial das síndromes parkinsonianas. A redução da espessura da PC sugeriu a presença de síndrome parkinsoniana, e a acentuação da hipointensidade de sinal do putâmen e a presença de lesão hiperintensa, em sua borda póstero-lateral, sugeriram o diagnóstico de AMS, principalmente em pacientes abaixo dos 50 anos. O grau de atrofia cerebral foi maior em pacientes com SPA do que na DP, e as lesões no mesencéfalo e na substância branca cerebral não foram úteis no diagnóstico diferencial das síndromes parkinsonianas. Portanto, a análise morfológica do mesencéfalo, particularmente da SN e dos núcleos da base através da RM, apresenta achados que auxiliam no diagnóstico das síndromes parkinsonianas. Apesar dos dados clínicos ainda serem fundamentais nestas doenças neurodegenerativas, o desenvolvimento de novos equipamentos e novas técnicas de RM, como a RM funcional e a espectroscopia por RM, pode fornecer novas perspectivas no diagnóstico das síndromes parkinsonianas.
REFERÊNCIAS 1.Greenberg DA, Aminoff MS, Simon RP. Distúrbios do movimento. In: Greenberg DA, Aminoff MS, Simon RP. Neurologia clínica. 2ª ed. Porto Alegre, RS: Editora Artes Médicas, 1996:227-50. [ ] 2.Hughes AJ, Daniel SE, Kilford L, Lees AJ. Accuracy of clinical diagnosis of idiopathic Parkinson's disease: a clinico-pathological study of 100 cases. J Neurol Neurosurg Psychiatry 1992;55:181-4. [ ] 3.Morens DM, Davis JW, Grandinetti A, Ross GW, Popper JS, White LR. Epidemiologic observations on Parkinson's disease: incidence and mortality in a prospective study of middle-aged men. Neurology 1996;46:1044-50. [ ] 4.Braffman BH, Grossman RI, Goldberg HI, et al. MR imaging of Parkinson disease with spin-echo and gradient-echo sequences. AJR 1989;152:159-65. [ ] 5.Drayer BP, Olanow W, Burger P, Johnson GA, Herfkens R, Riederer S. Parkinson plus syndrome: diagnosis using high field MR imaging of brain iron. Radiology 1986;159:493-8. [ ] 6.Duguid JR, De La Paz R, DeGroot J. Magnetic resonance imaging of the midbrain in Parkinson's disease. Ann Neurol 1986;20:744-7. [ ] 7.Hutchinson M, Raff U. Structural changes of the substantia nigra in Parkinson's disease as revealed by MR imaging. AJNR 2000;21:697-701. [ ] 8.Kraft E, Schwarz J, Trenkwalder C, Vogl T, Pfluger T, Oertel WH. The combination of hypointense and hyperintense signal changes on T2-weighted magnetic resonance imaging sequences: a specific marker of multiple system atrophy? Arch Neurol 1999;56:225-8. [ ] 9.Pastakia B, Polinsky R, Di Chiro G, Simmons JT, Brown R, Wener L. Multiple system atrophy (Shy-Drager syndrome): MR imaging. Radiology 1986; 159:499-505. [ ] 10.Schrag A, Kingsley D, Phatouros C, et al. Clinical usefulness of magnetic resonance imaging in multiple system atrophy. J Neurol Neurosurg Psychiatry 1998;65:65-71. [ ] 11.Stern MB, Braffman BH, Skolnick BE, Hurtig HI, Grossman RI. Magnetic resonance imaging in Parkinson's disease and parkinsonian syndromes. Neurology 1989;39:1524-6. [ ] 12.Brooks DJ. The early diagnosis of Parkinson's disease. Ann Neurol 1998;44(3 Suppl 1):S10-8. [ ] 13.Desaloms JM, Krauss JK, Lai EC, Jankovic J, Grossman RG. Posteroventral medial pallidotomy for treatment of Parkinson´s disease: preoperative magnetic resonance imaging features and clinical outcome. J Neurosurg 1998;89:194-9. [ ] 14.Pramstaller PP, Wenning GK, Smith SJ, Beck RO, Quinn NP, Fowler CJ. Nerve conduction studies, skeletal muscle EMG, and sphincter EMG in multiple system atrophy. J Neurol Neurosurg Psychiatry 1995;58:618-21. [ ] 15.Parker WD Jr, Boyson SJ, Parks JK. Abnormalities of the electron transport chain in idiopathic Parkinson's disease. Ann Neurol 1989;26:719-23. [ ] 16.Gasser T, Muller-Myhsok B, Wszolek ZK, et al. Genetic complexity and Parkinson's disease. Science 1997;277:388-9. [ ] 17.Sawle GV, Playford ED, Burn DJ, Cunningham VJ, Brooks DJ. Separating Parkinson's disease from normality: discriminant function analysis of fluordopa F 18 positron tomography data. Arch Neurol 1994;51:237-43. [ ] 18.Sawle GV. The detection of preclinical Parkinson's disease: what is the role of positron emission tomography? Mov Disord 1993;8:271-7. [ ] 19.Ellis CM, Lemmens G, Williams SC, et al. Changes in putamen N-acetylaspartate and choline ratios in patients untreated and levodopa-treated Parkinson's disease: a proton magnetic resonance spectroscopy study. Neurology 1997;49:438-44. [ ] 20.Federico F, Simone IL, Lucivero V, et al. Proton magnetic resonance spectroscopy in Parkinson's disease and atypical parkinsonian disorders. Mov Disord 1997;12:903-9. [ ] 21.Federico F, Simone IL, Lucivero V, et al. Proton magnetic resonance spectroscopy in Parkinson's disease and progressive supranuclear palsy. J Neurol Neurosurg Psychiatry 1997;62:239-42. [ ] 22.Adachi M, Hosoya T, Haku T, Yamaguchi K, Kawanami T. Evaluation of the substantia nigra in patients with Parkinsonian syndrome accomplished using multishot diffusion-weighted MR imaging. AJNR 1999;20:1500-6. [ ] 23.Bhattacharya K, Saadia D, Eisenkraft B, et al. Brain magnetic resonance imaging in multiple-system atrophy and Parkinson disease: a diagnostic algorithm. Arch Neurol 2002;59:835-42. [ ] 24.Gelb D, Oliver E, Gilman S. Diagnostic criteria for Parkinson disease. Arch Neurol 1999;56:33-9. [ ] 25.Meese W, Kluge W, Grumme T, Hopfenmuller W. CT evaluation of the CSF spaces of healthy persons. Neuroradiology 1980;19:131-6. [ ] 26.Wakai M, Kume A, Takahashi A, Ando T, Hashizume Y. A study of parkinsonism in multiple system atrophy: clinical and MRI correlation. Acta Neurol Scand 1994;90:225-31. [ ] 27.Aotsuka A, Shinotoh H, Hirayama K, Ikehira H, Hashimoto T. Magnetic resonance imaging in multiple system atrophy. Clin Neurol 1992;32:815-21. [ ] 28.Hu MT, Taylor-Robinson SD, Chaudhuri HR, et al. Evidence for cortical dysfunction in clinically non-demented patients with Parkinson's disease: a proton MR spectroscopy study. J Neurol Neurosurg Psychiatry 1999;67:20-6. [ ] 29.Ogawa T, Okudera T, Inugami A, et al. Degeneration of the ipsilateral substantia nigra after striatal infarction: evaluation with MR imaging. Radiology 1997;204:847-51. [ ] 30.Drayer BP. Degenerative disorders of the central nervous system. An integrated approach to the differential diagnosis. Neuroimaging Clin N Am 1995;5:135-53. [ ] 31.Oka M, Katayama S, Imon Y, Ohshita T, Mimori Y, Nakamura S. Abnormal signals on proton density-weighted MRI of the superior cerebellar peduncle in progressive supranuclear palsy. Acta Neurol Scand 2001;104:1-5. [ ] 32.Milton WJ, Atlas SW, Lexa FJ, Mozley PD, Gur RE. Deep gray matter hypointensity patterns with aging in healthy adults: MR imaging at 1.5 T. Radiology 1991;181:715-9. [ ] 33.Kitagaki H, Hirono N, Ishii K, Mori E. Corticobasal degeneration: evaluation of cortical atrophy by means of hemispheric surface display generated with MR images. Radiology 2000;216:31-8. [ ] 34.Otsuka M, Ichiya Y, Kuwabara Y, et al. Glucose metabolism in the cortical and subcortical brain structures in multiple system atrophy and Parkinson's disease: a positron emission tomographic study. Neurol Sci 1996;144:77-83. [ ] 35.Drayer BP. Imaging of the aging brain. Part I. Normal findings. Radiology 1988;166:785-96. [ ] 36.Zijlmans JC, Thijssen HO, Vogels OJ, et al. MRI in patients with suspected vascular parkinsonism. Neurology 1995;45:2183-8. [ ]
Recebido para publicação em 14/5/2003. Aceito, após revisão, em 11/7/2003.
* Trabalho realizado no Hospital de Clínicas de Porto Alegre (HCPA), Porto Alegre, RS, e no Serviço de Radiodiagnóstico do Hospital Universitário Clementino Fraga Filho da Universidade Federal do Rio de Janeiro (HUCFF-UFRJ), Rio de Janeiro, RJ. |
|
Av. Paulista, 37 - 7° andar - Conj. 71 - CEP 01311-902 - São Paulo - SP - Brazil - Phone: (11) 3372-4544 - Fax: (11) 3372-4554