Radiologia Brasileira - Publicação Científica Oficial do Colégio Brasileiro de Radiologia
AMB - Associação Médica Brasileira CNA - Comissão Nacional de Acreditação
 Vol. 44 nº 4 - Jul. / Ago. of 2011
Vol. 44 nº 4 - Jul. / Ago. of 2011
|
ARTIGO ORIGINAL
|
|
|
|
|
Autho(rs): Hugo Alexandre Sócrates de Castro1; Wagner Iared2; David Carlos Shigueoka3; José Eduardo Mourão4; Sérgio Ajzen5 |
|
|
Descritores: Próstata; Biópsia de próstata; Câncer de próstata; Densidade de PSA. |
|
|
Resumo: INTRODUÇÃO
O câncer de próstata, de acordo com a Organização Mundial da Saúde (OMS), é o segundo em incidência no homem, sendo a sexta causa de morte mais frequente entre a população masculina mundial. De acordo com o Instituto Nacional de Câncer (INCA), são esperados no Brasil cerca de 52.350 novos casos em 2010(1). O câncer de próstata acomete, na sua grande maioria, indivíduos com mais de 50 anos, é assintomático nas fases iniciais e ocorre preferencialmente na zona periférica da próstata. Apresenta taxa de mortalidade relativamente baixa, especialmente nos casos em que o diagnóstico é feito na fase inicial(2). Os exames mais utilizados para o rastreamento do câncer de próstata são o toque retal e a dosagem sérica do antígeno prostático específico (PSA). O toque retal apresenta limitações quando a lesão prostática não é palpável (estádios iniciais), e quando alterado, a diferenciação entre lesão maligna e benigna é difícil. A dosagem sérica de PSA, em uso clínico desde 1986, é o marcador tumoral mais frequentemente utilizado para o rastreamento do câncer de próstata. Tem importante papel no diagnóstico precoce deste câncer, impactando na redução de sua morbidade e mortalidade(3). As células epiteliais da zona de transição são as responsáveis pelos níveis séricos de PSA, e o aumento do volume prostático está diretamente relacionado com o aumento deste antígeno. Uma variedade de fatores pode afetar os níveis de PSA e deve ser considerada na interpretação dos resultados. As causas mais comuns de aumento do PSA são a prostatite, a hiperplasia prostática benigna e o câncer de próstata(4). O rastreamento com o exame de PSA tem como objetivo principal detectar o maior número possível de casos. Apesar de possuir alta sensibilidade, este exame tem baixa especificidade para o câncer de próstata, ou seja, para se manter taxas aceitáveis de diagnóstico, muitos pacientes são submetidos a biópsias desnecessárias. Existe uma zona de dúvida, tradicionalmente considerada a faixa de valores de PSA entre 4,1 e 10,0 ng/ml, em que todos os pacientes são considerados suspeitos para câncer de próstata. Mais recentemente, essa faixa tem sido definida entre 2,6 e 10,0 ng/ml(5), aumentando ainda mais o número de casos suspeitos. Nessa zona de dúvida, o PSA tem baixa especificidade, com cerca de 75% das biópsias prostáticas negativas para neoplasia(6). Para uma melhor triagem dos pacientes candidatos a esse procedimento, novos parâmetros vêm sendo analisados. Entre eles, temos a densidade de PSA (PSAD), que é a razão entre o valor absoluto do PSA e o volume da próstata. Alguns estudos sugerem que a PSAD poderia aumentar a especificidade do PSA(7). O Setor de Ultrassonografia Intervencionista do Departamento de Diagnóstico por Imagem da Universidade Federal de São Paulo (Unifesp) realiza, em média, 120 biópsias prostáticas ao mês; destas, cerca de 70% são negativas para neoplasia. Levando em consideração estes dados, e na tentativa de diminuir o número de biópsias desnecessárias, propusemos este trabalho, em que estudamos o perfil dos pacientes com valores de PSA entre 2,6 e 10,0 ng/ml submetidos a biópsia prostática, com o objetivo de identificar variáveis que pudessem aumentar a especificidade do PSA, evitando procedimentos desnecessários. MATERIAIS E MÉTODOS No período entre 2007 e 2009, foi realizado um estudo transversal, em homens com valores de PSA entre 2,6 e 10,0 ng/ml, encaminhados ao Setor de Ultrassonografia Intervencionista do Hospital São Paulo, para realização de biópsias prostáticas. Os pacientes foram avaliados de acordo com os seguintes parâmetros: idade do paciente, volume prostático, dosagem do PSA, exame anatomopatológico e, quando o resultado foi positivo para câncer, quais zonas foram atingidas e qual a classificação de Gleason para malignidade. Foram incluídos no estudo os pacientes que assinaram o termo de consentimento livre e esclarecido. O estudo foi aprovado pelo Comitê de Ética em Pesquisa da nossa Instituição. Foram excluídos os pacientes dos quais não foi possível verificar o valor do PSA, volume prostático ou o resultado do exame anatomopatológico e/ou não consentiram participar do estudo. A avaliação da próstata foi feita por via endorretal, utilizando aparelho modelo EnVisor (Philips; Eindhoven, Holanda), com transdutor de até 9 MHz. O volume prostático foi obtido segundo a fórmula: AP × CC × LL × 0,523 onde: AP é o diâmetro anteroposterior, CC é o diâmetro craniocaudal e LL , o diâmetro laterolateral (Figura 1). 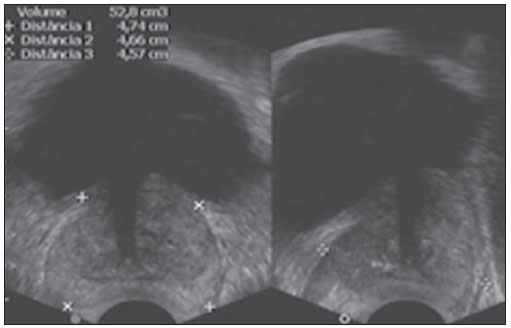 Figura 1. Exame ultrassonográfico transretal com medida do volume. Foi considerada PSAD o resultado da divisão do PSA pelo volume da próstata(7). As biópsias foram realizadas retirando-se 12 fragmentos da zona periférica, com agulhas de 18 G, sendo dois em cada sextante, um lateral e outro medial. Os fragmentos foram colocados em frascos individuais e rotulados, especificando-se o sextante de onde foram retirados, e analisados separadamente pelo patologista. Nos casos de resultados positivos para câncer de próstata, foi utilizado o sistema de graduação de Gleason para malignidade(8,9). Correlacionamos a idade do paciente, o valor do PSA e o volume prostático com a presença de câncer. Quando o câncer foi presente, correlacionamos a sua localização com o grau de malignidade. Além disso, avaliamos a acurácia da PSAD em predizer o câncer de próstata nos pacientes com PSA total entre 2,6 e 10 ng/ml. Nas comparações entre grupos, foram utilizados o teste t de Student e o teste não-paramétrico de Mann-Whitney para dados normais e não normais, respectivamente. A capacidade da PSAD em diferenciar pacientes com e sem câncer foi avaliada por curva ROC e medidas de sensibilidade, especificidade, valores preditivos positivos (VPP) e negativos (VPN) e razões de verossimilhança positiva (RV+) e negativa (RV-). O nível de significância adotado foi 0,05. Os programas utilizados foram o SPSS for Windows, versão 17.0 e o RevMan 5.20. RESULTADOS Partindo de 1.384 pacientes recrutados no período de 2007 a 2009, 102 foram excluídos por não apresentarem dados referentes ao volume prostático, aos valores do exame de PSA ou ao resultado anatomopatológico, restando então 1.282 pacientes. Dos 1.282 pacientes submetidos a biópsia prostática, a prevalência de câncer foi de 28,6%. O restante, 71,4%, apresentou resultado negativo para câncer prostático. A média de idade dos pacientes foi de 65 anos, variando de 43 a 93 anos. Os pacientes que não tiveram confirmação de câncer de próstata tinham média de idade de 64,6 anos, enquanto os pacientes que apresentaram câncer de próstata tinham média de idade de 69,6 anos (Tabela 1). 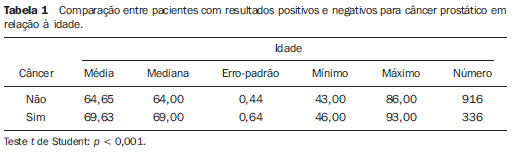 Quando se analisou o volume prostático, os pacientes com resultado positivo para câncer de próstata apresentaram média de volume prostático de 41,4 cm3. Para os pacientes com resultado negativo, o volume prostático teve média de 56,9 cm3 (Tabela 2). 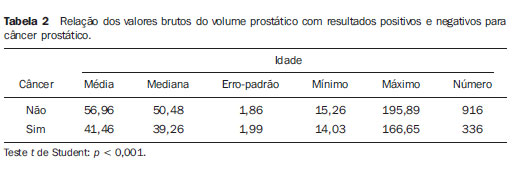 Na análise do exame de PSA, os pacientes com resultado positivo para câncer prostático apresentaram média de 8,9 ng/ml, enquanto os pacientes com resultado negativo tiveram média de 6,1 ng/ml. Ambos variaram entre 2,6 ng/ml e 10,0 ng/ml, que foi a faixa de resultados avaliada. Quando separamos duas faixas de incidência do PSA - em 2,6 a 4,0 ng/ml e 4,1 a 10,0 ng/ml -, observamos que na primeira havia 217 pacientes (17% do total) e 24 destes apresentaram câncer (11% dessa faixa), e que na segunda faixa havia 1.065 pacientes (83% do total) e a positividade foi de 32,1%. Ao se avaliar a PSAD, observamos que os pacientes com câncer prostático tiveram média de 0,31 ng/ml/cc. Nos pacientes com resultado negativo, a média foi de 0,10 ng/ml/cc (Tabela 3). 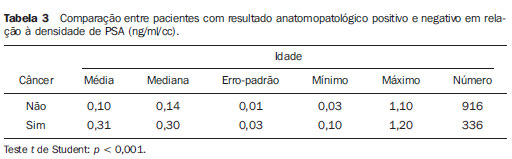 Utilizando-se como critério de positividade para câncer o ponto de corte de PSAD de 0,15 ng/ml/cc, sugerido pela literatura(7), a área sob a curva ROC foi de 0,720. Para este valor obtivemos especificidade de 74% (IC 95%: 71-77%) e sensibilidade de 70% (IC 95%: 65-74%). Como se trata de detecção de câncer, devemos minimizar o número de resultados falso-negativos e priorizar a sensibilidade. Neste caso, para aumentar a sensibilidade é preciso reduzir o ponto de corte. Com o valor 0,09 ng/ml/cc, obtivemos sensibilidade de 84% (IC 95%: 80-87%) e especificidade de 75% (IC 95%: 72-78%) e área sob a curva ROC de 0,794 (Figura 2). Calculamos também a RV para os dois pontos de corte escolhidos. Encontramos, para o critério de 0,15 ng/ml/cc um valor para RV+ de 2,72 e para RV- de 0,41. Já para o critério de 0,09 ng/ml/cc, encontramos um valor de RV+ de 3,36 e RV- de 0,21. 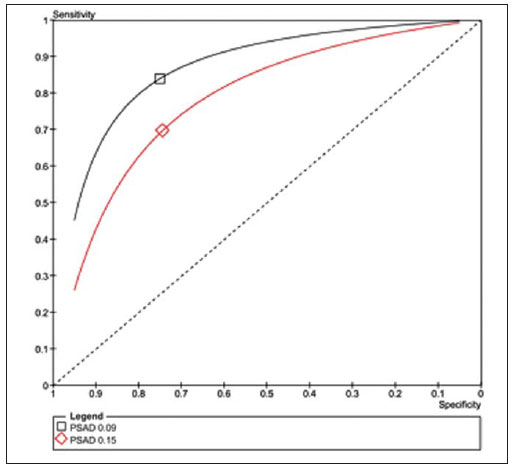 Figura 2. Comparação entre as curvas ROC para os pontos de corte de 0,15 ng/ml/cc e 0,09 ng/ml/cc. Para verificar se o desempenho da PSAD na predição do câncer de próstata estava relacionado com a idade, dividimos os pacientes em três subgrupos, de acordo com os tercis de distribuição, e analisamos o poder discriminatório da PSAD avaliado pela área sob a curva ROC. Em todas as análises a discriminação parece ser melhor nos pacientes mais idosos, porém sem significância estatística (Tabela 4). 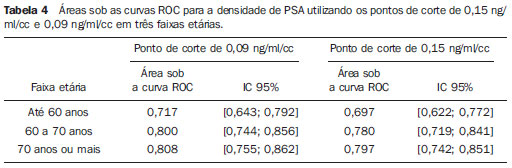 Analisando-se a localização da neoplasia e a pontuação dada pelo patologista segundo a classificação de Gleason, pudemos fazer uma análise comparativa entre esses dados. O resultado é mostrado a seguir, por um gráfico, em que se observa que não houve diferenças significativas entre o local de manifestação da neoplasia e seu grau de malignidade (Figura 3). 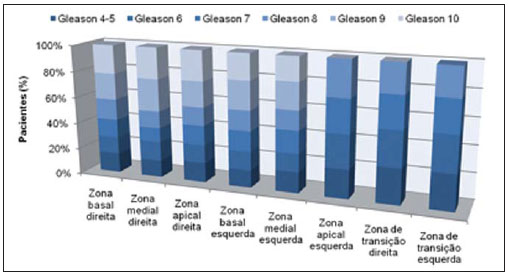 Figura 3. Gráfico da classificação de Gleason nas diferentes zonas da próstata. DISCUSSÃO Nosso estudo, ao avaliar o perfil dos pacientes submetidos a biópsia prostática no Hospital São Paulo, ressalta a importância da PSAD e seu impacto na redução de biópsias prostáticas desnecessárias, com suas consequentes complicações e custos. Há amplo consenso de que o nível de PSA é o melhor teste disponível para o rastreamento do câncer de próstata. Seu uso aumenta a detecção do câncer de próstata em até 81% quando comparado com o uso do toque retal isolado(3,4,10). Nos casos de PSA aumentado, é difícil a diferenciação entre câncer e hiperplasia prostática benigna, principalmente nos pacientes com níveis intermediários entre 2,6 e 10,0 ng/ml. Para otimizar a eficácia do PSA como teste diagnóstico nessa faixa, várias opções foram propostas, visando a incrementar a especificidade do teste e evitar biópsias desnecessárias, o que ocorre em cerca de 75% dos casos. No nosso estudo, traçamos o perfil dos pacientes submetidos a biópsia prostática, identificando variáveis que, aliadas aos valores de PSA entre 2,6 e 10,0 ng/ml, aumentassem sua especificidade. Observamos que a prevalência de câncer aumentou proporcionalmente com a idade. Mais de 65% de todos os cânceres de próstata serão diagnosticados em homens com mais de 65 anos(1,2), como ocorreu no nosso estudo, em que 72% dos pacientes com câncer tinham 65 anos ou mais. Quando analisamos o volume prostático, pudemos constatar que, nos pacientes com câncer prostático, os volumes (41,4 cm3) eram, em média, menores do que nos pacientes com resultado negativo (59,9 cm3). Este dado é corroborado por estudos em que próstatas com volumes pequenos, suspeitas ao toque retal e em pacientes com níveis de PSA elevado ou intermediário, estão significativamente associadas a evidências anatomopatológicas de adenocarcinoma(4,11). O PSA foi isolado pela primeira vez por Wang et al., em 1979(12). É produzido por células prostáticas normais e neoplásicas e sua concentração sérica está significativamente relacionada ao volume do câncer prostático(3,6). Os níveis do PSA são objetivos e facilmente reprodutíveis(6). Segundo alguns estudos, níveis abaixo de 4,0 ng/ml são considerados de baixo risco para adenocarcinoma da próstata(13,14). Nesse caso, valores abaixo de 4,0 ng/ml seriam considerados normais e o intervalo entre 4,1 e 10,0 ng/ml seria o intervalo de dúvidas ou intermediário. No nosso estudo, 17% apresentaram PSA abaixo de 4,0 ng/ml, e desses, 11% apresentaram positividade para câncer. Esses valores são semelhantes aos de outros estudos(15,16), que demonstraram uma menor prevalência do câncer nessa faixa de PSA entre 2,6 e 4,0 ng/ml. Já na faixa de PSA entre 4,1 e 10,0 ng/ml, que correspondia a 83% do total, a prevalência do câncer alcançou 32,1%. Observamos, também, que a média de valores do PSA nos indivíduos com câncer foi de 8,9 ng/ml, superior aos 6,1 ng/ml dos pacientes com resultado negativo para câncer. Apesar do estudo abranger uma faixa de resultados considerada intermediária, em que todos os pacientes são suspeitos, notamos uma maior concentração média do PSA nos indivíduos com câncer, dado este corroborado por outros estudos(13,16). Em 1992, Benson et al.(7) introduziram o conceito de PSAD como um método de aumentar a especificidade do PSA, dividindo o valor do PSA total pelo volume da próstata. Estudando 127 homens, essa análise propôs que, apesar de um grupo de homens ter níveis de PSA semelhantes, em níveis intermediários, estratificar esses valores pelo volume da próstata poderia correlacionar de forma mais significativa processos malignos ou benignos, diminuindo assim o número de biópsias desnecessárias, sem perda na detecção do câncer. Embora alguns autores reconheçam a utilidade da PSAD na diferenciação entre câncer e hiperplasia prostática benigna(11,17), outros questionam sua validade(18,19), uma vez que, quando usado isoladamente com o ponto de corte recomendado de 0,15 ng/ml/cc(7), a PSAD tem sensibilidade de aproximadamente 60%. Alguns anos mais tarde, Catalona et al.(6), em um estudo multicêntrico com 773 homens, sugeriram que o valor de PSAD fosse abaixado para 0,078 ng/ml/cc e dessa forma detectaria 95% dos tumores. Em nossa análise, os pacientes com resultados positivos para câncer apresentaram média da PSAD de 0,31 ng/ml/cc, e os com resultados negativos apresentaram média da PSAD de 0,10 ng/ml/cc. Se utilizássemos o ponto de corte de PSAD de 0,15 ng/ml/cc, a sensibilidade do teste seria de 65%, que, para um teste de rastreamento, seria baixo. Por outro lado, reduzindo esse valor para 0,09 ng/ml/cc, encontraríamos sensibilidade semelhante à obtida por Djavan et al.(20), de cerca de 83%. A especificidade com esses dois valores seria semelhante. Para um exame de rastreamento de câncer, devemos priorizar a alta sensibilidade (83,8%) e VPP (92,0%) do método. Assim, escolhendo o ponto de corte de 0,09 ng/ml/cc, reduziríamos o número de resultados falso-negativos. No estudo com o PSA na faixa entre 2,6 e 10,0 ng/ml, o número de pacientes submetidos a biópsias desnecessárias correspondeu a 71,4% dos procedimentos. Já com o uso da PSAD, esse número poderia ser reduzido a menos de 30% para ambos os pontos de corte. Utilizando a RV, encontramos valores para RV+ que indicam mudança moderada na probabilidade de câncer em ambos os pontos de corte. Porém, para RV-, encontramos valores que indicam pequena mudança na probabilidade de câncer para o ponto de corte de 0,15 ng/ml/cc (0,40) e mudança moderada para o ponto de corte de 0,09 ng/ml/cc (0,22). Por essa avaliação, o ponto de corte de 0,09 ng/ml/cc seria o mais indicado. Os pacientes com resultado do exame anatomopatológico positivo para câncer prostático foram analisados pelos patologistas, que utilizaram a classificação de Gleason para malignidade. Por ser uma análise passível de ser feita em todos os fragmentos, poderíamos descobrir onde ocorreriam os tumores mais ou menos diferenciados. Na nossa análise, não houve diferenças significativas entre a localização da neoplasia e seu grau de malignidade. Por meio do nosso estudo, observamos que os pacientes com câncer de próstata eram, em média, mais idosos, apresentavam valores de PSA e PSAD mais altos e tinham um menor volume da próstata. Nossos dados apontam a boa acurácia da PSAD na predição do câncer de próstata, com potencial de reduzir substancialmente a quantidade de biópsias desnecessárias. REFERÊNCIAS 1. Instituto Brasileiro de Geografia e Estatística; Ministério do Planejamento, Orçamento e Gestão. Estimativas populacionais 1980-2010: Brasil, regiões geográficas e unidades da federação [homepage na Internet]. Rio de Janeiro (Brasil): IBGE; 2010. [citado em 15 de junho de 2010]. Disponível em: http://www.ibge.gov.br 2. Jemal A, Siegel R, Ward E, et al. Cancer statistics, 2009. CA Cancer J Clin. 2009;59:225-49. 3. Gomes R, Rebello LEFS, Araújo FC, et al. A prevenção do câncer de próstata: uma revisão da literatura. Rev CS Col. 2008;13:235-46. 4. Nickel JC. Inflammation and benign prostatic hyperplasia. Urol Clin North Am. 2008;35:109-15. 5. Catalona WJ, Smith DS, Ornstein DK. Prostate cancer detection in men with serum PSA concentrations of 2.6 to 4.0 ng/mL and benign prostate examination. Enhancement of specificity with free PSA measurements. JAMA. 1997;277:1452-5. 6. Catalona WJ, Southwick PC, Slawin KM, et al. Comparison of percent free PSA, PSA density, and age-specific PSA cutoffs for prostate cancer detection and staging. Urology. 2000;56:255-60. 7. Benson MC, Whang IS, Pantuck A, et al. Prostate specific antigen density: a means of distinguishing benign prostatic hypertrophy and prostate cancer. J Urol. 1992;147(3Pt2):815-6. 8. Gleason DF. Classification of prostate carcinomas. Cancer Chemother Rep. 1966;50:125-8. 9. Sogani PC, Israel A, Lieberman PH, et al. Gleason grading of prostate cancer: a predictor of survival. Urology. 1985;25:223-7. 10. Catalona WJ, Richie JP, Ahmann FR, et al. Comparison of digital rectal examination and serum prostate specific antigen in the early detection of prostate cancer: results of a multicenter clinical trial of 6,630 men. J Urol. 1994;151:1283-90. 11. Babaian RJ, Fritsche HA, Evans RB. Prostate-specific antigen and the prostate gland volume: correlation and clinical application. J Clin Lab Anal. 1990;4:135-7. 12. Wang MC, Valenzuela LA, Murphy GP, et al. Purification of a human prostate specific antigen. 1979. J Urol. 2002;167(2Pt2):960-5. 13. Dennis LK, Resnick MI. Analysis of recent trends in prostate cancer incidence and mortality. Prostate. 2000;42:247-52. 14. Catalona WJ, Smith DS, Ratliff TL, et al. Measurement of prostate-specific antigen in serum as a screening test for prostate cancer. N Engl J Med. 1991;324:1156-61. 15. Colberg JW, Smith DS, Catalona WJ. Prevalence and pathological extent of prostate cancer in men with prostate specific antigen levels of 2.9 to 4.0 ng/ml. J Urol. 1993;149:507-9. 16. Krumholtz JS, Carvalhal GF, Ramos CG, et al. Prostate specific antigen cutoff of 2.6 ng/mL for prostate cancer screening is associated with favorable pathologic tumor features. Urology. 2002;60:469-74. 17. Veneziano S, Pavlica P, Querzé R, et al. Correlation between prostate-specific antigen and prostate volume, evaluated by transrectal ultrasonography: usefulness in diagnosis of prostate cancer. J Urol. 1990;18:112-6. 18. Lookner DH, Crawford ED, Donohue RE, et al. Prostate-specific antigen and prostate-specific antigen density in cases of pathologically proven prostate cancer. J Urol. 1993;149:414A. 19. Brawer MK, Aramburu EA, Chen GL, et al. The inability of prostate specific antigen index to enhance the predictive the value of prostate specific antigen in the diagnosis of prostatic carcinoma. J Urol. 1993;150(2Pt1):369-73. 20. Djavan B, Zlotta AR, Byttebier G, et al. Prostate specific antigen density of the transition zone for early detenction of prostate cancer. J Urol. 1998;160:411-9. 1. Mestre, Chefe da Coordenadoria do Setor de Intervenção Não Vascular do Departamento de Diagnóstico por Imagem da Universidade Federal de São Paulo (Unifesp), São Paulo, SP, Brasil. 2. Doutor, Chefe da Coordenadoria do Setor de Ultrassonografia do Departamento de Diagnóstico por Imagem da Universidade Federal de São Paulo (Unifesp), São Paulo, SP, Brasil. 3. Doutor, Professor Afiliado do Departamento de Diagnóstico por Imagem da Universidade Federal de São Paulo (Unifesp), São Paulo, SP, Brasil. 4. Doutor, Médico Assistente do Departamento de Diagnóstico por Imagem da Universidade Federal de São Paulo (Unifesp), São Paulo, SP, Brasil. 5. Professor Titular, Chefe do Departamento de Diagnóstico por Imagem da Universidade Federal de São Paulo (Unifesp), São Paulo, SP, Brasil. Endereço para correspondência: Dr. Hugo Alexandre Sócrates de Castro Rua Caconde, 281, ap. 12, Jardim Paulista São Paulo, SP, Brasil, 01425-011 E-mail: halsoc@gmail.com Recebido para publicação em 2/5/2011. Aceito, após revisão, em 7/6/2011. Trabalho realizado na Universidade Federal de São Paulo (Unifesp), São Paulo, SP, Brasil. |
|
Av. Paulista, 37 - 7° andar - Conj. 71 - CEP 01311-902 - São Paulo - SP - Brazil - Phone: (11) 3372-4544 - Fax: (11) 3372-4554