INTRODUÇÃO
O câncer de pulmão não pequenas células (CPNPC) corresponde a cerca de 85% de todas as neoplasias de pulmão, sendo a principal causa de mortes por câncer no Brasil, atualmente. A mortalidade por CP-NPC no ano de 2000 no Brasil, estimada pelo Instituto Nacional de Câncer (INCA), foi de 14.715 pacientes(1), com 27.270 novos casos no ano de 2008(2).
O estadiamento inicial no CPNPC determina o melhor tratamento e é essencial para a definição do prognóstico(3,4). O estadiamento incorreto pode acarretar tratamento inadequado (cirurgias fúteis em pacientes com doença avançada), assim como contraindicar cirurgia curativa em pacientes com doença potencialmente curável(5,6).
O sistema de classificação para estadiamento mais usado é o TNM (
tumor, nodal, metastasis), definido pelo American Joint Committee on Cancer, baseado no tamanho do tumor, envolvimento nodal regional e presença de metástase. A definição do estádio nodal (N) é particularmente importante para a definição de terapia neoadjuvante antes da ressecção cirúrgica, podendo melhorar a sobrevida em longo prazo no estádio IIIA de pacientes com CPNPC(7-9). Diversas ferramentas de diagnóstico têm sido investigadas para a detecção precoce e estadiamento do CPNPC, incluindo radiografia de tórax, tomografia computadorizada (TC), ressonância magnética (RM), broncoscopia, videotoracoscopia, ultrassonografia transesofágica (USTE) ou transbrônquica (USTB) e mediastinoscopia.
A tomografia por emissão de pósitrons (PET) com [
18F]-fluoro-2-desoxi-D-glicose (FDG) tem consistentemente desempenhado papel importante no estadiamento não invasivo pré-operatório de pacientes portadores de CPNPC(10-12). A FDG-PET tem alta acurácia no estadiamento N e M em comparação com a TC e, portanto, apresentado grande impacto na identificação de doença irressecável(13-15). No entanto, os custos adicionais decorrentes da introdução desta nova tecnologia precisam ser determinados. Desta forma, o objetivo deste estudo foi avaliar o impacto do estadiamento metabólico (EM) com FDG-PET no estadiamento inicial de pacientes portadores de CPNPC no Brasil e determinar a custo-efetividade desta estratégia em relação ao estadiamento convencional (EC).
MATERIAIS E MÉTODOS
Pacientes
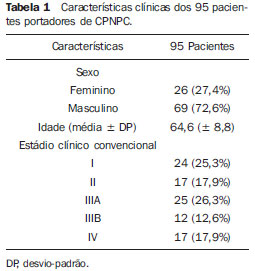
Este estudo prospectivo, aprovado pelo Comitê de Ética da Universidade de São Paulo/Hospital das Clínicas, incluiu 95 pacientes consecutivos com diagnóstico recente de CPNPC confirmado por biópsia. Os pacientes foram encaminhados pelo Serviço de Pneumologia do Instituto do Coração (InCor) do Hospital da Clínicas da Faculdade de Medicina da Universidade de São Paulo (HC-FMUSP). Foi obtido consentimento informado de todos os pacientes elegíveis no período de agosto de 2005 a dezembro de 2007. Os critérios de exclusão foram: gravidez e outro tumor concomitante.
Todos os 95 pacientes foram submetidos ao EC e EM, enquanto RM e cintilografia óssea foram realizadas apenas quando clinicamente relevante.
Estadiamento convencional
Todos os pacientes foram submetidos ao EC, incluindo: exame físico, exame laboratorial (LDH, fosfatase alcalina, enzimas hepáticas, bilirrubina, função renal, cálcio) e TC (tórax, abdome e pelve). Na TC foram realizados cortes com espessura de 1 mm e administrados meios de contraste oral e intravenoso em todos os pacientes.
RM do crânio e cintilografia óssea foram realizadas apenas na presença de sintomas neurológicos e dor óssea, respectivamente. USTE com biópsia foi realizada na suspeita de envolvimento em linfonodo mediastinal.
O estádio clínico convencional de cada paciente foi atribuído de acordo com o "The revised TNM staging for lung cancer"(16).
FDG-PET
Foram adquiridas imagens tomográficas do crânio até a raiz das coxas em equipamento PET dedicado (GE Advance; GE Healthcare, Waukesha, WI, EUA), 60 a 90 minutos após a administração intravenosa de 296-444 MBq (8-12 mCi) de FDG. As imagens foram reconstruídas nos planos axial, coronal e sagital. Correção de atenuação foi realizada utilizando fontes
68Ge.
Os estudos foram interpretados por dois médicos nucleares experientes, com título de especialista em medicina nuclear. Os resultados de FDG-PET foram analisados em conjunto com resultados de TC. Áreas de concentração não fisiológicas com a concentração de FDG maior que a concentração de fundo foi classificado como positivo para doença. O EM de cada paciente foi atribuído de acordo com sistema de estadiamento TNM.
O intervalo entre a realização de CT e PET não foi maior que duas semanas.
Tratamento e acompanhamento
O estádio TNM final foi obtido em reunião de consenso do grupo de oncologistas e especialistas em diagnóstico por imagem, com base em todas as informações disponíveis (dados clínicos, TC e FDG-PET inicial, broncoscopia, mediastinoscopia e USTE se realizadas). USTE foi considerada o padrão de referência para a avaliação pré-operatória de linfonodos mediastinais.
Os pacientes foram classificados em grupos para definição do plano de tratamento: (i) estádio I: cirurgia curativa; (ii) estádio II a IIIA (ressecável): cirurgia curativa com quimioterapia adjuvante; (iii) estádio IIIB: quimioterapia e radioterapia combinada; (iv) estádio IV: quimioterapia paliativa. A modificação de tratamento após o EM foi definido quando houve mudança no plano de tratamento original, baseado nos resultados de FDG-PET. Achados positivos apenas no estudo de FDG-PET foram confirmados por biópsia ou USTE, a critério do médico assistente.
Todos os pacientes foram acompanhados de acordo com o padrão convencional local, sendo avaliados a cada três meses ou menos por no mínimo um ano.
Padrão de referência e análise de dados
Uma vez que o exame anatomopatológico de todos os sítios possíveis de acometimento por CPNPC não é viável, por óbvias razões éticas e práticas, para a definição da acurácia dos métodos diagnósticos, foram utilizados os resultados combinados dos métodos convencionais e FDG-PET para a definição de um padrão de referência. Achados concordantes positivos de PET, TC (ou cintilografia óssea e RM, se realizadas) foram interpretados como verdadeiro-positivos. Achados concordantes negativos na avaliação clínica e de imagem foram considerados verdadeiro-negativos. Em casos de N discordantes ao EC e EM, os critérios utilizados para definir o resultado foi a avaliação anatomopatológica por USTE nos estádios IIIA ou IIIB ou em amos-tragem de linfonodos na toracotomia, ou o desenvolvimento de recidiva local, metástases a distância ou óbito até um ano após a toracotomia (estádio IV da doença). Os dados foram coletados prospectivamente.
Na análise do estádio clínico foram comparados os resultados do EC e EM, quando a FDG-PET indicou mudança na abordagem cirúrgica se o estádio do paciente mudou de I a IIIA para IIIB a IV, e viceversa; em relação à radioterapia, se o estádio mudou de IIIB para IV e vice-versa.
Sobre pacientes considerados elegíveis para a cirurgia por EC e EM, a toracotomia foi considerada fútil quando a avaliação anatomopatológica das peças cirúrgicas confirmou doença estádio IIIB ou IV, ou no caso de recidiva ou morte por qualquer causa até um ano após a cirurgia.
A acurácia diagnóstica foi analisada somando o número de pacientes com resultados verdadeiro-positivos e verdadeironegativos dividido pelo número total de pacientes. A diferença entre os métodos de imagem foi avaliada por teste de McNemar χ
2. SPSS 10.0 para Windows (SPSS Inc.; Chicago, IL, EUA) foi utilizado para a análise estatística.
Análise de custo-efetividade
Foram observados e quantificados, prospectivamente, todos os recursos de saúde necessários para avaliação e tratamento. Medicamentos, procedimentos (incluindo investigações, quimioterapia, radioterapia, procedimentos cirúrgicos, dias de internação, atendimentos ambulatoriais e hospitalares) ou qualquer recurso de outros cuidados locais utilizados foram calculados por técnica de microcusteio. O HC-FMUSP é um hospital público estadual e toda aquisição de material ou medicamentos é realizada por pregão eletrônico em licitações para todo o Estado. Os custos dos recursos foram atualizados para 2010. Os honorários médicos não foram incluídos.
O estádio clínico do paciente define o tratamento a que ele deve ser submetido. O custo médio de cada estádio da doença foi calculado em cada grupo. O impacto econômico do EC (estratégia I), do EC + FDGPET (estratégia II) e da estratégia de PET/ TC (estratégia III) foi calculado.
Os custos nas estratégias de estadiamento e tratamento de primeira linha foram calculados com base nos custos reais da estratégia II (EC + FDG-PET) e estimados nas estratégias I e III.
RESULTADOS
As características clínicas dos pacientes estão especificadas na Tabela 1.
Acurácia e impacto na modificação no EC e na terapia
Na Tabela 2 é exposta a comparação do EC e o EM com FDG-PET. O EC e o EM foram concordantes em 44/95 (46,3%) dos pacientes. Em 51/95 (53,7%) pacientes o EM foi discordante do EC: 46/95 (48,4%) pacientes tiveram seu estadiamento modificado para mais avançado com a informação da FDG-PET (Figura 1), enquanto 5/95 (5,3%) pacientes tiveram seu estadiamento modificado para mais precoce (Figura 2).
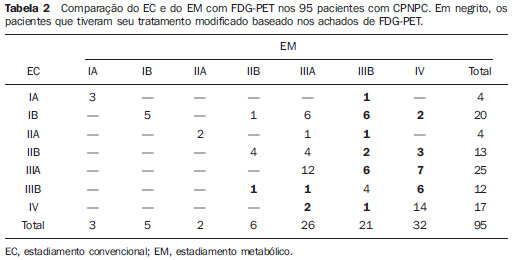
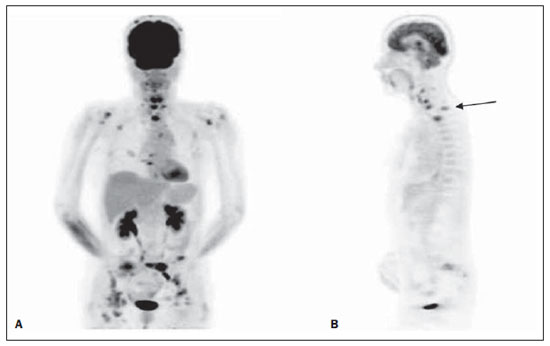
Figura 1. Paciente do sexo feminino, tabagista, em estadiamento inicial de CPNPC. Ao EC apresentava doença operável. No entanto, as imagens de FDG-PET revelaram aumento do metabolismo glicolítico em linfonodos cervicais bilaterais e no mediastino, além de metástases ósseas (A: reformatação tridimensional), notadamente na coluna cervical e torácica (B: corte sagital).
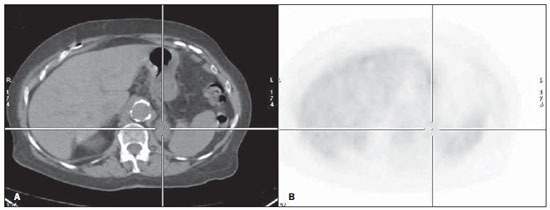
Figura 2. Paciente do sexo masculino, tabagista, em estadiamento inicial de CPNPC. Ao EC apresentava doença inoperável, com provável metástase adrenal esquerda à TC (A: corte axial), porém sem aumento do metabolismo (B: corte axial). Nos exames de controle não houve alteração nas dimensões da adrenal esquerda.
Considerando todos os casos, a inclusão da FDG-PET no EC mudaria o tratamento em 39/95 (41,0%) pacientes quanto à abordagem terapêutica cirúrgica (I-IIIA ↔ IIIB-IV) e em 7/95 (7,4%) pacientes (IIIB ↔ IV) em relação à radioterapia.
Em relação ao padrão de referência, a PET estadiou corretamente 86/95 (90,5%) pacientes, em comparação com 53/95 (55,8%) casos com EC. A PET foi considerada falso-positiva em 8 pacientes e a TC em 4 casos, enquanto a PET foi falso-negativa em 1 paciente e a CT em 38 pacientes. Houve diferença estatisticamente significante entre TC e os resultados PET (MacNemar teste χ
2:
p < 0,001).
Considerando-se o tratamento final, a informação da PET determinaria modificação no tratamento em 39 pacientes, em 9 casos o tratamento foi o sugerido pelo EC, enquanto em 30 pacientes os resultados foram definidos pelas informações da PET, evitando a cirurgia em 21 pacientes, sugerindo cirurgia em 2 pacientes, radioterapia em 6 pacientes e evitando radioterapia em 1 paciente. De acordo com o resultado final do tratamento, o EM definiu corretamente o tratamento em 86/95 (90,5%) dos pacientes e o EC em 65/95 (68,4%).
Toracotomia fútil
As informações de estadiamento determinaram indicação de tratamento cirúrgico curativo por toracotomia em 33 pacientes com base no EM e em 66 com base no EC.
Dos 66 pacientes com indicação para tratamento cirúrgico por EC, o procedimento foi considerado inútil em 31 (47%): 11 pacientes com estádio IV da doença confirmada, 9 foram reclassificados como CP-NPC inoperável baseado nos achados anatomopatológicos por EUS e 15 morreram em menos de um ano após toracotomia.
Considerando o EM, 8/42 pacientes (19%) seriam submetidos a toracotomia fútil: um caso inoperável baseado na USTE, um paciente com estádio IV que faleceu, além de outros seis pacientes (quatro pacientes estádio IIIA e dois estádio IIB) que também faleceram em menos de um ano após a toracotomia.
Análise de custos locais
Os custos médios dos procedimentos foram os seguintes: biópsia, R$ 624; TC, R$ 1.200; RM, R$ 400; laboratório e bioquímica, R$ 398; USTE, R$ 1.287; FDG-PET, R$ 1.330; PET/TC, R$ 2,037. Os custos das três estratégias diferentes estão apresentados na Tabela 3.
O custo médio de cada modalidade de tratamento foi: cirurgia e procedimentos hospitalares, R$ 9.965; quimioterapia adjuvante, R$ 8.422; radioterapia, R$ 8.000. Os custos de estadiamento e tratamento de primeira linha são mostrados na Tabela 4.
O estadiamento inicial dos 95 pacientes por procedimentos de TC teve custo total de R$ 114.000, enquanto por FDG-PET o custo foi de R$ 126.350. O custo calculado de PET/TC seria de R$ 193.515 nestes mesmos pacientes. O EM com FDG-PET modificaria o estádio de doença em um número considerável de pacientes, determinando mudança na estratégia de tratamento em 39/95 (41,0%) pacientes.
O número de exames adicionais, como a RM de crânio e a cintilografia óssea, permaneceria o mesmo em ambas as estratégias. No entanto, no EC a USTE seria realizada em 26 pacientes com estádios IB a IIIA com doença N2, e no EM com a estratégia II ou III a USTE seria realizada em 27 pacientes.
O custo da toracotomia fútil em 31 pacientes no EC somou R$ 308.915; já em 8 pacientes no EM somou R$ 79.720, representando economia total de R$ 229.195.
O custo médio de estadiamento e tratamento de primeira linha na estratégia I por EC seria R$ 16.983 por paciente, na estratégia II (TC + PET) seria R$ 17.985, e a estratégia III (com PET/TC) teria custo médio de R$ 17.492 por paciente.
DISCUSSÃO
Pacientes com CPNPC com estádios clínicos IA, IB, IIA, IIB da doença podem se beneficiar de ressecção cirúrgica curativa. Pacientes com estádios IIIB e IV são inoperáveis, enquanto pacientes com estádio IIIA raramente satisfazem os critérios para a cirurgia. O papel atual da quimioterapia neoadjuvante para pacientes com doença em estádio IIIA selecionados permanece controverso(16).
Nossos resultados confirmam os benefícios do EM comparado ao EC, levando a uma definição mais precisa do estádio da doença e, portanto, a uma estratégia de tratamento cada vez mais refinada para cada paciente. A informações da FDG-PET resultou na modificação do estádio de doença em cerca da metade dos casos (51/95; 53,7%) e na modificação do tratamento em aproximadamente um terço (30/95; 31,6%) dos casos, principalmente ao evitar tratamento desnecessário em um terço dos pacientes (21 casos tiveram cirurgia contraindicada e radioterapia contraindicada em 6) e sugerindo tratamento mais agressivo em uma minoria (2 pacientes para tratamento cirúrgico e radioterapia em 1).
Vários outros estudos demonstraram o impacto clínico significativo da FDG-PET no estadiamento inicial de pacientes com CPNPC, variando de 22% a 67%(5,17-19). Ao comparar o EC
vs. EC + EM, é importante considerar também os custos dos exames e procedimentos subsequentes que são executados para investigação dos resultados deste novo método. Em nosso estudo, a estratégia de investigação incluindo FDG-PET aumentou o número de procedimentos subsequentes em apenas 1 dos 95 pacientes.
Alguns estudos randomizados(5,20,21) sugerem que a FDG-PET e a FDG-PET/TC melhoram a acurácia do estadiamento do mediastino no CPNPC, em comparação com a TC, confirmando estudos anteriores não randomizados(22-28). Os equipamentos híbridos de PET/TC normalmente têm melhor desempenho do que equipamentos de PET apenas, otimizando a interpretação de ambas as modalidades ao permitir a localização mais precisa das áreas com aumento do metabolismo(29-33).
Três importantes estudos randomizados relataram o impacto da adição de FDG-PET ao EC no estadiamento de CPNPC(5,21,22). Os resultados foram diferentes. Viney et al.(20) tiveram como desfecho primário a realização de toracotomia, que foi efetuada em 98% dos pacientes do grupo de EC e em 96% no grupo de EM com FDG-PET além do EC (
p = 0,44), e demonstraram que a adição de PET não reduziu significativamente o número de toracotomias. O desfecho principal do estudo de van Tinteren et al.(5) foi toracotomia fútil. A taxa de toracotomia fútil foi de 41% no grupo de EC e 21% no grupo de EM com PET associado ao EC (
p < 0,003). Em 2009, Fischer et al.(21) randomizaram a investigação por EC e EM seguida da investigação de qualquer anormalidade. A taxa de toracotomia fútil foi de 52% no grupo de EC e de 35% no grupo de EC associado ao EM. Nossos resultados estão em conformidade com estes dois últimos trabalhos, demonstrando os benefícios com o EM, com uma taxa significativamente menor de toracotomia fútil em relação à taxa por EC (19%
versus 47%).
Existem escassos estudos sobre FDG-PET em pacientes brasileiros(34,35), e os que abordam a análise de custo-efetividade são mais raros ainda(36). A utilização racional de recursos é extremamente relevante para o sistema público de saúde, mais ainda nos países em desenvolvimento como o Brasil, e deve ser levado em conta que os resultados de estudos de custo-efetividade de determinados países não podem ser necessariamente aplicados em outros. No caso do presente estudo, nossos resultados corroboram os resultados de outros países e demonstram a custo-efetividade do EM com FDG-PET no CPNPC. Os custos de toracotomia fútil em oito pacientes no EM somaram R$ 79.720, enquanto em 31 pacientes no EC somaram R$ 308.915. Apenas a economia (R$ 229.195) relacionada a estes custos seria mais que suficiente para cobrir os custos de todos os exames de FDG-PET nos 95 pacientes (R$ 126.350) ou mesmo de FDG-PET/TC (R$ 193.515).
Deve-se levar em conta que nossos resultados podem ser questionados em relação ao uso de equipamentos de PET em vez de PET/TC para o estadiamento de CP-NPC. No entanto, é interessante notar que nossos dados de acurácia são bastante semelhantes aos dados relatados para PET/ TC. Isso pode ser explicado pela correlação cuidadosa das imagens de PET e TC durante a leitura do exame de FDG-PET. A principal desvantagem do nosso estudo é a ausência da confirmação histológica de todas as lesões. Mediastinoscopia era considerada o padrão ouro para estadiamento N do mediastino até recentemente(16). No entanto, tecnologias novas e menos invasivas estão emergindo, como a USTE e a USTB. Assim, por sobreposição de áreas anatômicas, a mediastinoscopia não foi obrigatória em nosso estudo. Além disso, seria mais elegante um ensaio randomizado e controlado, porém por razões éticas não foi possível a sua realização.
CONCLUSÃO
Nosso estudo demonstra que o EM com FDG-PET tem maior acurácia em relação ao EC com TC. Além disso, FDG-PET é uma modalidade de imagem custo-efetiva no estadiamento de CPNPC, selecionando melhor os pacientes para tratamento mais adequado em cerca de metade dos casos e reduzindo o número de toracotomia fútil de 47% para 19%.
A introdução do EM com FDG-PET ou FDG-PET/TC apresenta-se como opção bastante custo-efetiva e com custo aceitável para o estadiamento do CPNPC e, portanto, sua utilização se justifica economicamente na saúde pública no Brasil.
REFERÊNCIAS
1. Instituto Nacional de Câncer. Tipos de câncer - pulmão. [acessado em 3 de julho de 2012]. Disponível em: http://www2.inca.gov.br/wps/wcm/connect/tiposdecancer/site/home/pulmao
2. Instituto Nacional de Câncer. Incidência de câncer no Brasil - estimativa 2007. [acessado em 4 de fevereiro de 2011]. Disponível em: http://www.inca.gov.br/estimativa/2007
3. Molina JR, Yang P, Cassivi SD, et al. Non-small cell lung cancer: epidemiology, risk factors, treatment, and survivorship. Mayo Clin Proc. 2008;83:584-94.
4. Tanoue LT. Staging of non-small cell lung cancer. Semin Respir Crit Care Med. 2008;29:248-60.
5. van Tinteren H, Hoekstra OS, Smit EF, et al. Effectiveness of positron emission tomography in the preoperative assessment of patients with suspected non-small-cell lung cancer: the PLUS multi-centre randomised trial. Lancet. 2002;359:1388-93.
6. Swensen SJ, Brown LR, Colby TV, et al. Lung nodule enhancement at CT: prospective findings. Radiology. 1996;201:447-55.
7. Rosell R, Felip E. Role of multimodality treatment for lung cancer. Semin Surg Oncol. 2000;18:143-51.
8. Spásová I, Petera J, Hytych V. The role of neoadjuvant chemotherapy in marginally resectable or unresectable stage III non-small cell lung cancer. Neoplasma. 2002;49:189-96.
9. Roth JA, Atkinson EN, Fossella F, et al. Longterm follow-up of patients enrolled in a randomized trial comparing perioperative chemotherapy and surgery with surgery alone in resectable stage IIIA non-small-cell lung cancer. Lung Cancer. 1998;21:1-6.
10. Toloza EM, Harpole L, McCrory DC. Noninvasive staging of non-small cell lung cancer: a review of the current evidence. Chest. 2003;123(1 Suppl):137S-146S.
11. Vesselle H, Pugsley JM, Vallières E, et al. The impact of fluorodeoxyglucose F 18 positron-emission tomography on the surgical staging of nonsmall cell lung cancer. J Thorac Cardiovasc Surg. 2002;124:511-9.
12. Graeter TP, Hellwig D, Hoffmann K, et al. Mediastinal lymph node staging in suspected lung cancer: comparison of positron emission tomography with F-18-fluorodeoxyglucose and mediastinoscopy. Ann Thorac Surg. 2003;75:231-6.
13. Kalff V, Hicks RJ, MacManus MP, et al. Clinical impact of (18)F fluorodeoxyglucose positron emission tomography in patients with non-smallcell lung cancer: a prospective study. J Clin Oncol. 2001;19:111-8.
14. Lowe VJ, Naunheim KS. Positron emission tomography in lung cancer. Ann Thorac Surg. 1998;65:1821-9.
15. Stroobants S, Verschakelen J, Vansteenkiste J. Value of FDG-PET in the management of nonsmall cell lung cancer. Eur J Radiol. 2003;45:49-59.
16. Silvestri GA, Gould MK, Margolis ML, et al. Noninvasive staging of non-small cell lung cancer: ACCP evidenced-based clinical practice guidelines (2nd edition). Chest. 2007;132(3 Suppl):178S-201S.
17. Pieterman RM, van Putten JW, Meuzelaar JJ, et al. Preoperative staging of non-small-cell lung cancer with positron-emission tomography. N Engl J Med. 2000;343:254-61.
18. Miele E, Spinelli GP, Tomao F, et al. Positron emission tomography (PET) radiotracers in oncology - utility of 18F-fluoro-deoxy-glucose (FDG)-PET in the management of patients with non-small-cell lung cancer (NSCLC). J Exp Clin Cancer Res. 2008;27:52.
19. Subedi N, Scarsbrook A, Darby M, et al. The clinical impact of integrated FDG PET-CT on management decisions in patients with lung cancer. Lung Cancer. 2009;64:301-7.
20. Viney RC, Boyer MJ, King MT, et al. Randomized controlled trial of the role of positron emission tomography in the management of stage I and II non-small-cell lung cancer. J Clin Oncol. 2004;22:2357-62.
21. Fischer B, Lassen U, Mortensen J, et al. Preoperative staging of lung cancer with combined PET-CT. N Engl J Med. 2009;361:32-9. Erratum in: N Engl J Med. 2011;364:982.
22. Herder GJ, Kramer H, Hoekstra OS, et al. Traditional versus up-front [18F] fluorodeoxyglucosepositron emission tomography staging of nonsmall-cell lung cancer: a Dutch cooperative randomized study. J Clin Oncol. 2006;24:1800-6.
23. [No authors listed]. Investigating extrathoracic metastatic disease in patients with apparently operable lung cancer. The Canadian Lung Oncology Group. Ann Thorac Surg. 2001;71:425-34.
24. Pieterman RM, van Putten JW, Meuzelaar JJ, et al. Preoperative staging of non-small-cell lung cancer with positron-emission tomography. N Engl J Med. 2000;343:254-61.
25. Saunders CA, Dussek JE, O'Doherty MJ, et al. Evaluation of fluorine-18-fluorodeoxyglucose whole body positron emission tomography imaging in the staging of lung cancer. Ann Thorac Surg. 1999;67:790-7.
26. Weder W, Schmid RA, Bruchhaus H, et al. Detection of extrathoracic metastases by positron emission tomography in lung cancer. Ann Thorac Surg. 1998;66:886-93.
27. MacManus MP, Hicks RJ, Ball DL, et al. F-18 fluorodeoxyglucose positron emission tomography staging in radical radiotherapy candidates with nonsmall cell lung carcinoma: powerful correlation with survival and high impact on treatment. Cancer. 2001;92:886-95.
28. Ung YC, Maziak DE, Vanderveen JA, et al; Lung Cancer Disease Site Group of Cancer Care Ontario's Program in Evidence-Based Care. 18Fluorodeoxyglucose positron emission tomography in the diagnosis and staging of lung cancer: a systematic review. J Natl Cancer Inst. 2007;99:1753-67.
29. Hicks RJ, Kalff V, MacManus MP, et al. (18)F-FDG PET provides high-impact and powerful prognostic stratification in staging newly diagnosed non-small cell lung cancer. J Nucl Med. 2001;42:1596-604.
30. Cerfolio RJ, Ojha B, Bryant AS, et al. The accuracy of integrated PET-CT compared with dedicated PET alone for the staging of patients with nonsmall cell lung cancer. Ann Thorac Surg. 2004;78:1017-23.
31. Lardinois D, Weder W, Hany TF, et al. Staging of non-small-cell lung cancer with integrated positron-emission tomography and computed tomography. N Engl J Med. 2003;348:2500-7.
32. Halpern BS, Schiepers C, Weber WA, et al. Presurgical staging of non-small cell lung cancer: positron emission tomography, integrated positron emission tomography/CT, and software image fusion. Chest. 2005;128:2289-97.
33. Antoch G, Stattaus J, Nemat AT, et al. Non-small cell lung cancer: dual-modality PET/CT in preoperative staging. Radiology. 2003;229:526-33.
34. Cerci JJ, Pracchia LF, Linardi CC, et al. 18F-FDG PET after 2 cycles of ABVD predicts event-free survival in early and advanced Hodgkin lymphoma. J Nucl Med. 2010;51:1337-43. Erratum in: J Nucl Med. 2010;51:1658.
35. Pracchia LF, Chaves AA, Cerci JJ, et al. Metabolic test with fluorine-18-fluorodeoxyglucose in staging and detection of residual tumor or recurrence in Hodgkin lymphoma. Clinics (Sao Paulo). 2007;62:121-6.
36. Cerci JJ, Trindade E, Pracchia LF, et al. Cost effectiveness of positron emission tomography in patients with Hodgkin's lymphoma in unconfirmed complete remission or partial remission after first-line therapy. J Clin Oncol. 2010;28:1415-21.
1. Doutor, Diretor do Centro de PET-CT da Quanta - Diagnóstico e Terapia, Curitiba, PR, Médico Pesquisador do Instituto do Coração (InCor) do Hospital das Clínicas da Faculdade de Medicina da Universidade de São Paulo (HC-FMUSP), São Paulo, SP, Brasil.
2. Pós-Doutorado, Professora da Universidade de São Paulo (USP), São Paulo, SP, Brasil.
3. Doutora, Núcleo de Avaliação de Tecnologia do Instituto do Coração (InCor) do Hospital das Clínicas da Faculdade de Medicina da Universidade de São Paulo (HC-FMUSP), São Paulo, SP, Brasil.
4. Médica Nuclear Pesquisadora do Serviço de Medicina Nuclear do Instituto do Coração (InCor) do Hospital das Clínicas da Faculdade de Medicina da Universidade de São Paulo (HC-FMUSP), São Paulo, SP, Brasil.
5. Médicos Pneumologistas do Serviço de Pneumologia do Instituto do Coração (InCor) do Hospital das Clínicas da Faculdade de Medicina da Universidade de São Paulo (HC-FMUSP), São Paulo, SP, Brasil.
6. Doutor, Diretor do Centro de PET-CT do Serviço de Medicina Nuclear do Instituto do Coração (InCor) do Hospital das Clínicas da Faculdade de Medicina da Universidade de São Paulo (HC-FMUSP), São Paulo, SP, Brasil.
7. Pós-Doutor, Diretor do Serviço de Pneumologia do Instituto do Coração (InCor) do Hospital das Clínicas da Faculdade de Medicina da Universidade de São Paulo (HC-FMUSP), São Paulo, SP, Brasil.
Endereço para correspondência:
Dr. Juliano Julio Cerci
Núcleo de Avaliação de Tecnologia do Instituto do Coração (InCor)- FMUSP
Avenida Doutor Enéas de Carvalho Aguiar, 44, AB, Cerqueira César
São Paulo, SP, Brasil, 05403-000
E-mail: cercijuliano@hotmail.com
Recebido para publicação em 15/5/2012.
Aceito, após revisão, em 28/6/2012.
Trabalho realizado no Instituto do Coração (InCor) do Hospital das Clínicas da Faculdade de Medicina da Universidade de São Paulo (HC-FMUSP), São Paulo, SP, Brasil. Este estudo foi patrocinado pelo Ministério da Saúde do Brasil.
 Vol. 45 nº 4 - Jul. / Ago. of 2012
Vol. 45 nº 4 - Jul. / Ago. of 2012