Radiologia Brasileira - Publicação Científica Oficial do Colégio Brasileiro de Radiologia
AMB - Associação Médica Brasileira CNA - Comissão Nacional de Acreditação
 Vol. 46 nº 3 - Maio / Jun. of 2013
Vol. 46 nº 3 - Maio / Jun. of 2013
|
ENSAIO ICONOGRÁFICO
|
|
|
|
|
Autho(rs): Paulo Moraes Agnollitto1; André Rodrigues Façanha Barreto1; Raul Fernando Pinsetta Barbieri1; Jorge Elias Junior2; Valdair Francisco Muglia2 |
|
|
Descritores: Rendu-Osler-Weber; Teleangiectasia hemorrágica hereditária; Fístulas arteriovenosas; Epistaxe. |
|
|
Resumo: INTRODUÇÃO
A síndrome de Rendu-Osler-Weber ou teleangiectasia hemorrágica hereditária (THH) é uma doença vascular autossômica dominante com penetrância variável(1,2) que acomete múltiplos órgãos e sistemas e é caracterizada por lesões angiodisplásticas que promovem a comunicação entre artérias e veias, sem a interposição de um leito capilar(3). As manifestações clínicas mais comuns são teleangiectasias cutaneomucosas e epistaxe, além de sangramento pulmonar, gastrintestinal e intracerebral(4-6). A prevalência relatada da doença é de 1/100.000 a 2/100.000 nascidos vivos(7), mas pode chegar a 1/3.500 a 1/5.000 em algumas regiões específicas(8). Os primeiros relatos da doença são de Benjamin Guy Babington em 1865, John Wickham Legg em 1876 e Henri J. L. M. Rendu em 1886. Posteriormente, William Osler, Frederick Parkes Weber e Frederic M. Hanes descreveram manifestações viscerais e o caráter hereditário da doença(1). Neste artigo relatamos três casos dessa síndrome, ressaltando os critérios diagnósticos e os aspectos de imagem, com revisão da literatura. CASO 1 Paciente do sexo feminino, 57 anos de idade, mulata, com queixa de epistaxe de repetição e lesões cutâneas do tipo petéquias, com distribuição perioral e periungueais. Durante o exame clínico foi identificada lesão ulcerada no septo nasal, a qual foi submetida a biópsia e o resultado histopatológico revelou processo inflamatório crônico, com a presença de estruturas arredondadas sugestivas de Leishmania sp. em sua forma amastigota. Como parte da investigação do quadro infeccioso (leishmaniose) realizou-se radiografia de tórax, que demonstrou nódulo pulmonar (Figura 1A). Prosseguindo a investigação, foi solicitada tomografia de tórax (Figura 1B), que evidenciou a natureza vascular da lesão. Foi levantada a hipótese de THH e foram solicitados exames complementares - tomografia computadorizada (TC) e ressonância magnética (RM) - do abdome e encéfalo (Figuras 1 a 4). Foi realizado tratamento da epistaxe com tamponamento local. A paciente interrompeu seguimento em nosso serviço. 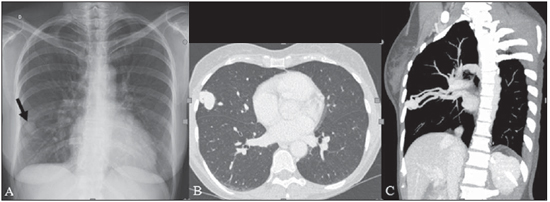 Figura 1. A: Radiografia de tórax em posteroanterior mostrando nódulo com densidade de partes moles no pulmão direito (seta). B: Corte axial de TC do tórax, com algoritmo de projeção de máxima intensidade (MIP) mostrando nódulo com atenuação de partes moles no lobo médio do pulmão direito. C: Reconstrução MPR oblíqua evidenciando natureza vascular do nódulo descrito previamente, com pelo menos dois ramos arteriais pulmonares nutrindo um nidus malformativo e uma veia pulmonar principal de drenagem (malformação arteriovenosa pulmonar). 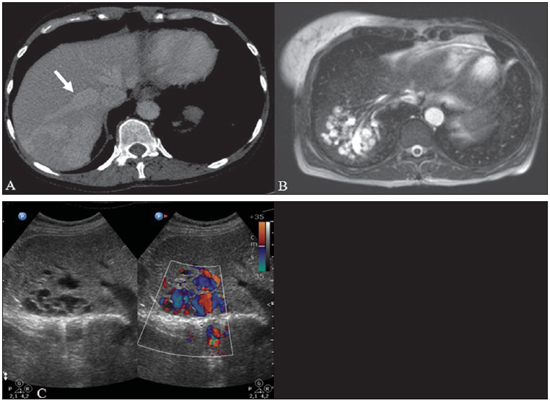 Figura 2. A: Corte axial de TC com contraste demonstrando lesão de natureza vascular acometendo o segmento VII hepático, associada a dilatação da veia hepática direita (seta). B: Corte axial de RM ponderada em T2 identificando a malformação vascular hepática, provavelmente portossistêmica. C: Cortes longitudinais de US com color-Doppler demonstrando a natureza vascular da lesão. 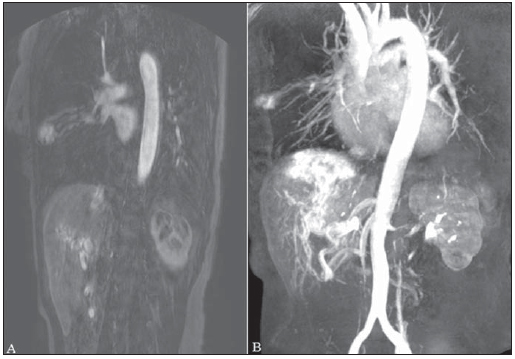 Figura 3. A: Corte coronal de RM pós-gadolínio demonstrando lesão nodular pulmonar de natureza vascular, concordante com a tomografia. B: Angio-RM de abdome pós-contraste no plano coronal demonstrando acometimento pulmonar e hepático pela doença. 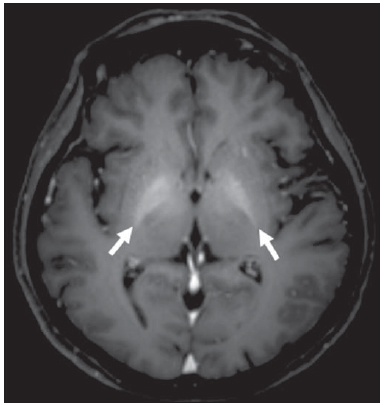 Figura 4. Corte axial de RM do encéfalo ponderada em T1 evidenciando hipersinal nos globos pálidos (setas), compatível com acúmulo de manganês, confirmando a presença de shunt portossistêmico. CASO 2 Paciente do sexo feminino, 43 anos de idade, branca, apresentando queixa de epistaxe recorrente há cerca de 20 anos, além de lesões avermelhadas em lábios, língua, mãos e tronco. Foi submetida a TC de tórax e angiotomografia do abdome, que revelaram achados típicos da THH (Figuras 5 e 6). Em nenhuma ocasião foi necessário algum tratamento com tamponamento e a paciente está em seguimento há três anos, sem apresentar complicações. Essa paciente tem, ainda, uma filha de oito anos com epistaxe recorrente, desde os quatro anos de idade, em início de avaliação no serviço, sem exames de imagem disponíveis até o momento. 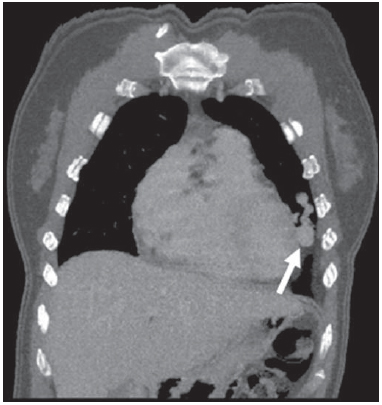 Figura 5. Reconstrução MPR coronal identificando nódulo com densidade de partes moles associado a vasos no segmento lingular inferior do pulmão esquerdo. 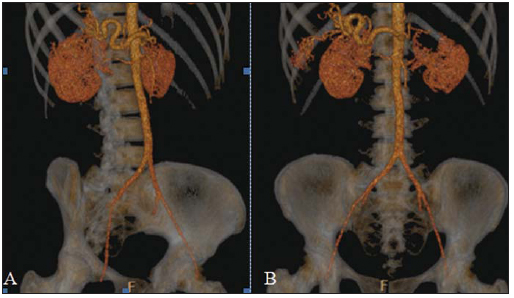 Figura 6. Reconstruções volumétricas de angiotomografia da aorta evidenciando artéria hepática de calibre aumentado em toda sua extensão (A) e agrupamento de vasos arteriais serpiginosos no interior do parênquima hepático (B), compatível com fístula intra-hepática. CASO 3 Paciente do sexo feminino, 36 anos de idade, branca, com quadro febril, foi submetida a radiografia de tórax durante a internação, que evidenciou nódulos pulmonares. Ao exame físico, apresentava baqueteamento digital. Realizou-se TC do tórax, que evidenciou a natureza vascular das lesões visualizadas na radiografia (Figura 7). O foco infeccioso relacionado à febre foi diagnosticado como pielonefrite, não relacionada às alterações da THH, com tratamento satisfatório com antibioticoterapia, sendo que na investigação diagnóstica pôde-se verificar história familiar positiva para a doença, considerando familiar com passado de epistaxe recorrente. Não foi necessário tratamento específico e a paciente está em seguimento há seis meses, sem apresentar complicações ou sintomas relacionados aos achados da doença. 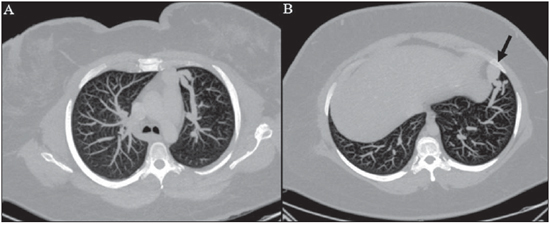 Figura 7. Cortes axiais de TC do tórax com algoritmo de máxima intensidade de projeção MIP evidenciando vasos anômalos calibrosos no parênquima pulmonar (A), nódulo no seio costofrênico anterior em continuidade com vasos serpiginosos dilatados (B), caracterizando fístula arteriovenosa pulmonar. DISCUSSÃO A avaliação por métodos de imagem do sistema vascular tem sido motivo de uma série de publicações recentes na literatura radiológica nacional(9-20). A THH é diagnosticada com base na presença de três dos quatro critérios de Curaçao(5,6): 1) teleangiectasias cutaneomucosas; 2) epistaxe espontânea recorrente; 3) malformações arteriovenosas (MAVs) viscerais; 4) história familiar positiva. A THH pode ser confirmada pela identificação das mutações envolvidas, com técnicas de biologia molecular. Os três casos relatados neste trabalho foram diagnosticados como THH, preenchendo os critérios de Curaçao. Há duas mutações descritas envolvidas na patogênese da doença: a) a mutação no gene da endoglina, localizado no cromossomo 9q e que determina a THH tipo 1, a qual apresenta acentuado envolvimento pulmonar; b) a mutação no gene da activina, localizado no cromossomo 12q e que determina a THH tipo 2, que cursa com envolvimento predominantemente extrapulmonar(4). Os casos apresentados não foram submetidos a análise genética. A doença se caracteriza por sintomas progressivos durante a vida, sendo a epistaxe a primeira manifestação, com início por volta dos 10 anos de idade e com episódios cada vez mais graves. Dois dos casos descritos neste estudo apresentaram epistaxe como sintoma principal, enquanto o outro teve detecção incidental de lesões pulmonares. As teleangiectasias também surgem progressivamente e os sítios mais comuns são lábios, língua, palato, dedos e face. As principais complicações da doença se devem a MAVs pulmonares, que determinam shunt direita-esquerda, podendo causar dispneia, hemoptise, embolia paradoxal e abscessos cerebrais, o que não ocorreu em nenhum paciente desta casuística. Malformações vasculares hepáticas - arterioportais, arteriovenosas e portossistêmicas - também podem causar shunt direitaesquerda e determinar graus variados de hipertensão pulmonar, insuficiência cardíaca e encefalopatia hepática. Em estudo com 35 crianças, Giordano et al.(21) encontraram teleangiectasias nasais em 68%, teleangiectasias cutaneomucosas (dedos, lábios e cavidade oral) em 79%, MAVs pulmonares em 53%, MAVs hepáticas em 47% e MAVs cerebrais e/ou alterações cerebrais isquêmicas secundárias a MAVs pulmonares em 12%. MAVs cerebrais podem causar migrânea e hemorragia intraparenquimatosa e/ou subaracnoidea. Nenhum dos casos relatados neste trabalho apresentou sintomas neurológicos. Outro achado de neuroimagem que pode colaborar para o diagnóstico, já descrito em associação com shunts portossistêmicos congênitos e bem demonstrado no caso 1, é o hipersinal em T1 dos núcleos da base, notadamente dos globos pálidos, que indica o acúmulo de manganês no sistema nervoso central. Este achado não é específico e pode estar associado a condições como nutrição parenteral, hepatopatia crônica com ou sem encefalopatia, shunts portossistêmicos adquiridos ou congênitos e insuficiência renal crônica dialítica, com aumento do manganês sérico(22,23). Dentre os diagnósticos diferenciais destacam-se: a síndrome de malformação capilar cutânea com MAVs viscerais (de partes moles, cerebrais ou ósseas), causada por mutação no RASA1; a síndrome de Adams-Oliver (com teleangiectasias cutâneas, MAVs pulmonares e defeitos de membros e couro cabeludo; ou a malformação vascular retinocefálica (síndrome de Wyburn-Mason), as quais podem falsamente preencher os critérios de Curaçao para THH. O tratamento da THH inclui medidas para: controle da epistaxe (tampões locais e laser); controle da anemia ferropriva com suplementação de ferro e, se necessário, transfusões; controle das MAVs pulmonares, cerebrais e hepáticas com embolização cautelosa, tendo como alternativas, respectivamente, ressecção cirúrgica, radioterapia e transplante hepático(1). Os dois casos que apresentaram epistaxe foram tratados com tampão local, enquanto um dos pacientes foi submetido a embolização endovascular de MAV pulmonar em razão de escarros hemoptoicos. As situações mais frequentes que podem ocorrer no dia a dia do radiologista com relação a essa rara síndrome são: a) o achado incidental de uma MAV visceral em paciente sem o diagnóstico prévio da síndrome; b) realização de exame direcionado para pesquisa ou controle de alterações viscerais em pacientes com o diagnóstico já estabelecido. Nos casos apresentados, verifica-se que o diagnóstico foi levantado principalmente pela detecção de epistaxe e hemoptise, enquanto em um caso ocorreu achado incidental de lesão pulmonar de aspecto vascular. Portanto, concluímos que é importante que na presença de achado sugestivo de MAV visceral o radiologista tenha em mente os critérios diagnósticos para a THH, os quais podem ser pesquisados diretamente com o paciente no momento da execução do exame ou ainda solicitando essas informações com o colega que indicou o exame. Nos casos de pacientes com epistaxe ou hemoptise recorrente que forem submetidos a exames de imagem torácico ou abdominal, deve-se ficar atento para a presença de lesões que sugiram malformações vasculares. Uma vez firmado o diagnóstico de THH em um adulto, deve-se realizar o rastreamento de lesões vasculares abdominais (principalmente hepáticas) e pulmonares em crianças da mesma família, com ultrassonografia abdominal, radiografia simples e, eventualmente, TC de tórax(21). REFERÊNCIAS 1. Cottin V, Dupuis-Girod S, Lesca G, et al. Pulmonary vascular manifestations of hereditary hemorrhagic telangiectasia (rendu-osler disease). Respiration. 2007;74:361-78. 2. Sabbà C, Pasculli G, Cirulli A, et al. Rendu-Osler-Weber disease: experience with 56 patients. Ann Ital Med Int. 2002;17:173-9. 3. Memeo M, Scardapane A, De Blasi R, et al. Diagnostic imaging in the study of visceral involvement of hereditary haemorrhagic telangiectasia. Radiol Med. 2008;113:547-66. 4. Carette MF, Nedelcu C, Tassart M, et al. Imaging of hereditary hemorrhagic telangiectasia. Cardiovasc Intervent Radiol. 2009;32:745-57. 5. Sadick H, Sadick M, Götte K, et al. Hereditary hemorrhagic telangiectasia: an update on clinical manifestations and diagnostic measures. Wien Klin Wochenschr. 2006;118:72-80. 6. Siddiki H, Doherty MG, Fletcher JG, et al. Abdominal findings in hereditary hemorrhagic telangiectasia: pictorial essay on 2D and 3D findings with isotropic multiphase CT. Radiographics. 2008;28:171-84. 7. Buscarini E, Buscarini L, Civardi G, et al. Hepatic vascular malformations in hereditary hemorrhagic telangiectasia: imaging findings. AJR Am J Roentgenol. 1994;163:1105-10. 8. Sabba C, Pasculli G, Cirulli A, et al. Hereditary hemorrhagic teleangiectasia (Rendu-Osler-Weber disease). Minerva Cardioangiol. 2002;50:221-38. 9. Bezerra KB, Bacelar Jr EA, Pereira NCS, et al. Gastric arteriovenous malformation: treatment by embolization. Radiol Bras. 2012;45:126-8. 10. Monteiro HF, Torres PPTS, Edelhoff VNG, et al. Nutcracker syndrome [which is your diagnosis?]. Radiol Bras. 2012;45:xiii-xiv. 11. Brandão AHF, Barbosa AS, Lopes APBM, et al. Dopplerfluxometry of ophthalmic arteries and assessment of endothelial function in early and late preeclampsia. Radiol Bras. 2012;45:20-3. 12. Novero ER, Metzger PB, Obregon J, et al. Endovascular treatment of thoracic aortic diseases: a single center result analysis. Radiol Bras. 2012;45:251-8. 13. Novero ER, Metzger PB, Angelieri FMR, et al. Endovascular repair of abdominal aortic aneurysm: a single-center results analysis. Radiol Bras. 2012;45:1-6. 14. Farret Neto A, Faria EDB, Pantaleo E, et al. Anterior tibial artery recanalization through dorsalis pedis artery: a case report. Radiol Bras. 2012;45:302-4. 15. Guimarães Filho A, Carneiro Neto LA, Palheta MS, et al. Caroli's disease complicated with liver abscess: case report. Radiol Bras. 2012;45:362-4. 16. Iyeyasu JN, Silva Júnior NA, Bertanha R, et al. Carotid-cavernous fistula [which is your diagnosis?]. Radiol Bras. 2012;45:xiii-xiv. 17. Iared W, D'Ippolito G. Doppler flowmetry in hepatic steatosis. Radiol Bras. 2011;44(1):v. 18. Ceratti S, Okano FM, Pontes ABG, et al. Ultrasound-guided foam sclerotherapy in the treatment of chronic venous insufficiency. Radiol Bras. 2011;44:167-71. 19. Wajnberg E, Rodrigues G, Abud DG. Use of drugeluting stents for the treatment of vertebral artery stenosis. Radiol Bras. 2011;44:343-8. 20. Bastos AL, Brito ILA. Pulmonary artery aneurysms in Behçet's disease: case report. Radiol Bras. 2011;44:396-8. 21. Giordano P, Nigro A, Lenato GM, et al. Screening for children from families with Rendu-Osler-Weber disease: from geneticist to clinician. J Thromb Haemost. 2006;4:1237-45. 22. da Silva CJ, da Rocha AJ, Jeronymo S, et al. A preliminary study revealing a new association in patients undergoing maintenance hemodialysis: manganism symptoms and T1 hyperintense changes in the basal ganglia. AJNR Am J Neuroradiol. 2007;28:1474-9. 23. Rovira A, Alonso J, Cordoba J. MR imaging findings in hepatic encephalopathy. AJNR Am J Neuroradiol. 2008;29:1612-21. 1. Médicos Residentes de Radiologia e Diagnóstico por Imagem do Hospital das Clínicas da Faculdade de Medicina de Ribeirão Preto da Universidade de São Paulo (HC-FMRPUSP), Ribeirão Preto, SP, Brasil. 2. Livre-docentes, Docentes do Centro de Ciências das Imagens e Física Médica do Departamento de Clínica Médica do Hospital das Clínicas da Faculdade de Medicina de Ribeirão Preto da Universidade de São Paulo (HC-FMRPUSP), Ribeirão Preto, SP, Brasil. Endereço para correspondência: Dr. Paulo Moraes Agnollitto Avenida Caramuru, 2300, República Ribeirão Preto, SP, Brasil, 14030-000 E-mail: agno53@gmail.com Recebido para publicação em 28/8/2012. Aceito, após revisão, em 15/2/2013. * Trabalho realizado no Hospital das Clínicas da Faculdade de Medicina de Ribeirão Preto da Universidade de São Paulo (HC-FMRPUSP), Ribeirão Preto, SP, Brasil. |
|
Av. Paulista, 37 - 7° andar - Conj. 71 - CEP 01311-902 - São Paulo - SP - Brazil - Phone: (11) 3372-4544 - Fax: (11) 3372-4554