Radiologia Brasileira - Publicação Científica Oficial do Colégio Brasileiro de Radiologia
AMB - Associação Médica Brasileira CNA - Comissão Nacional de Acreditação
 Vol. 47 nº 2 - Mar. / Abr. of 2014
Vol. 47 nº 2 - Mar. / Abr. of 2014
|
ARTIGO DE REVISÃO
|
|
|
|
|
Autho(rs): Marcos Duarte Guimaraes1; Alice Schuch2; Bruno Hochhegger3; Jefferson Luiz Gross4; Rubens Chojniak5; Edson Marchiori6 |
|
|
Descritores: Imagem em oncologia; Ressonância magnética; Oncologia; Neoplasia; Imagem funcional; Difusão. |
|
|
Resumo: INTRODUÇÃO
Desde que Wilhelm Conrad Röntgen realizou a descoberta dos raios X em 1895, na Alemanha, a imaginologia vem se desenvolvendo e ampliando os campos de atuação na medicina(1). Na área da oncologia, a imagem vem desempenhando papel fundamental ao fornecer informações valiosas para o melhor manejo dos pacientes portadores de neoplasias. Ela pode ser empregada em diversas etapas, desde o rastreamento até o seguimento pós-terapêutico(2,3). Os métodos de imagem mais frequentemente empregados são a radiografia, a ultrassonografia e a tomografia computadorizada (TC), sendo muitas vezes os únicos métodos disponíveis para a avaliação dos pacientes com câncer. Estas ferramentas se baseiam primariamente nas anormalidades anatômicas e, quando disponível, no padrão de alterações de realce pós-contraste das estruturas acometidas(4). Entretanto, com os avanços terapêuticos e tecnológicos, uma avaliação morfológica exclusiva pode ser insuficiente em muitos momentos, para uma tomada de decisão terapêutica apropriada. Um exemplo são os "critérios de avaliação de reposta nos tumores sólidos" (RECIST), cujo dado principal é a avaliação do maior diâmetro da lesão. Diversos estudos da literatura têm demonstrado as limitações deste critério em predizer comportamento biológico e sucesso terapêutico. As novas terapias oncológicas criaram um paradigma na avaliação do paciente com câncer. Os critérios funcionais se tornaram mais fidedignos em retratar a atividade da doença e a resposta biológica ao tratamento, de forma distinta dos critérios morfológicos tradicionais(5). Atualmente, a ressonância magnética (RM) é um método de diagnóstico por imagem muito bem estabelecido na prática clínica, mas em contínuo desenvolvimento(6). Há mais de 30 anos este método vem apresentando significativo progresso em diferentes áreas da medicina, especialmente em oncologia, incluindo distintas etapas do manejo oncológico, como detecção, caracterização, estadiamento, avaliação de resposta e seguimento pós-terapêutico(7). A RM produz imagens em três dimensões de forma não invasiva, sem os riscos da radiação ionizante e com ótima resolução espacial e de contraste, permitindo uma avaliação tumoral bastante fidedigna. Atualmente, o principal foco das inovações está no alcance na evolução da resolução anatômica e, mais recentemente, no advento de métodos moleculares e funcionais. Estes avanços promoveram uma revolução no uso desta ferramenta na avaliação e manejo dos pacientes oncológicos(8). Em se tratando de avaliação neoplásica, a RM é capaz de fornecer informações, do ponto de vista morfológico, como tamanho, contornos, quantidade de lesões, presença de edema e necrose, relação com estruturas adjacentes e características referentes ao emprego do contraste intravenoso(6). Entretanto, alterações fisiológicas e do metabolismo celular, que habitualmente antecedem as alterações morfológicas, não costumam ser identificadas com as técnicas morfológicas empregadas na rotina. O advento de novas técnicas de RM possibilitou a avaliação funcional das estruturas e dos diferentes processos fisiológicos do microambiente tumoral(7,8). Uma análise conjunta dos aspectos anatômicos e funcionais possibilita uma avaliação mais completa em termos de distribuição e atividade da doença oncológica. A avaliação adequada do status oncológico possibilita o estabelecimento de melhores estratégias terapêuticas, com impacto favorável no prognóstico e sobrevida(7-9). Como exemplos da relevância da análise funcional pela RM destacam-se a análise da angiogênese mediante técnica de perfusão, a análise do metabolismo celular utilizando a espectroscopia e a análise de celularidade por meio da técnica de difusão. O objetivo do presente artigo de revisão é abordar alguns dos principais avanços da RM funcional e seu impacto no manejo do paciente oncológico. DIFUSÃO O princípio da imagem de RM ponderada na sequência de difusão (DWI) diz respeito ao movimento ao acaso, também conhecido como movimento "browniano" dos prótons das moléculas de água através dos tecidos biológicos. Esse movimento causa dispersão fásica dos spins, resultando em perda do sinal na sequência sensível à difusão. Entretanto, no corpo humano existem barreiras biológicas naturais a este movimento, decorrentes da interação com as membranas celulares e as macromoléculas (Figura 1). 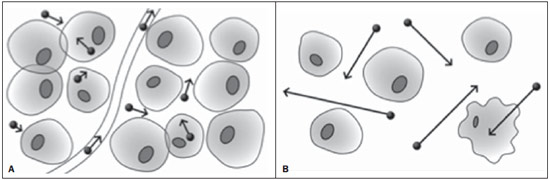 Figura 1. Demonstração do movimento de moléculas de água entre os espaços intra e extracelular e dentro do espaço extracelular fornecendo informações sobre o grau de celularidade dos tecidos. Em A existe maior quantidade de células restringindo a movimentação das moléculas de água; em B a celularidade é menor, com maior movimentação das moléculas. A DWI possibilita a análise qualitativa da difusão das moléculas de água nos tecidos, mediante simples interpretação da intensidade do sinal da região objeto de estudo. É possível também a análise quantitativa por meio do cálculo do coeficiente aparente de difusão (ADC), atribuindo-se valores absolutos em mm2/s para a intensidade do sinal da região objeto de estudo(9). A técnica é fundamentada na existência de barreiras que restringem a difusão das moléculas de água no seu microambiente, produzindo diferentes contrastes em diferentes tecidos. A movimentação destas moléculas nos espaços intracelulares, extracelulares e intravasculares contribui para o equilíbrio de sua distribuição, que reflete, em última análise, a integridade das barreiras encontradas nestas estruturas. A barreira à difusão das moléculas de água mais conhecida é a membrana celular. Outros exemplos de barreiras são os componentes estruturais, conexões celulares e conexões teciduais, tais como o citoesqueleto, as macromoléculas, as organelas e as tight junctions. Consequentemente, diferentes tecidos exibirão intensidade de sinal e ADC próprios, considerando suas particularidades estruturais(9,10). O emprego deste método vem sendo descrito na literatura em diferentes estudos, incluindo os que avaliam a capacidade de identificação de lesões teciduais isquêmicas do cérebro, sendo capaz de detectar mínimas alterações, muitas vezes antecedendo o surgimento das alterações morfológicas. A DWI pode ser aplicada também na avaliação de outros tipos de lesões cerebrais, incluindo processos neoplásicos (Figura 2), inflamatórios, infecciosos e neurodegenerativos(10). 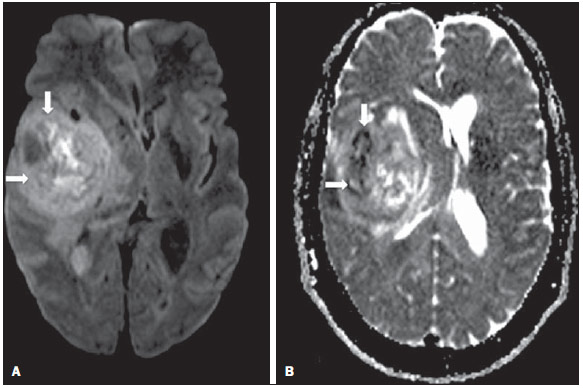 Figura 2. Paciente do sexo feminino, 37 anos, portadora de glioblastoma multiforme acometendo o lobo parietal direito. Em A observam-se áreas de hipersinal na sequência de difusão (setas), apresentando correlação com áreas de perda de sinal no mapa de ADC em B, denotando restrição à movimentação das moléculas de água e elevada celularidade. Cortesia do Dr. Leonardo Vedolin – Hospital Moinho de Vento, Porto Alegre, RS. O avanço da DWI possibilitou a aplicação desta ferramenta na avaliação de órgãos extracranianos(11,12). O advento de técnicas de imagem ecoplanar, de bobinas multicanais e de imagens em paralelo foi decisivo na obtenção de imagens de melhor qualidade, permitindo que a DWI fosse aplicada ao estudo de outros órgãos. A redução dos artefatos de movimento durante a fase de aquisição, como os relacionados aos batimentos cardíacos, à respiração e ao peristaltismo intestinal, tem como finalidade evitar que haja comprometimento na qualidade dos exames e que a análise e interpretação dos achados sejam prejudicados(9). Dentre os parâmetros aplicados na imagem de difusão, um dos mais relevantes é conhecido como "valor b". Este parâmetro é capaz de regular o nível de sensibilidade desta sequência, sendo proporcional à duração e amplitude do gradiente aplicado e ao intervalo de tempo entre os gradientes(10). A DWI é caracteristicamente realizada através do emprego de pelo menos dois valores b (por exemplo, b = 0 ou b baixo, com valores entre 50 e 100, e um b alto, com valores entre 800 e 1000 s/mm2). Nas imagens com b baixo observam-se imagens mais "anatômicas" com atenuação dos efeitos da perfusão, ou seja, com atenuação dos vasos e do liquor. Entretanto, nas imagens com b alto, os tecidos com elevada celularidade aparecem com sinal elevado (Figura 3). No caso dos tecidos tumorais, a movimentação da água é dificultada pela existência de diversas barreiras, mantendo o brilho do sinal. Por outro lado, os tecidos que não apresentam desorganização celular aparecem com sinais atenuados (Figura 4). A avaliação visual da atenuação do sinal em DWI é aplicada na detecção e caracterização de tumores, assim como na avaliação da resposta ao tratamento em pacientes oncológicos(9-12). 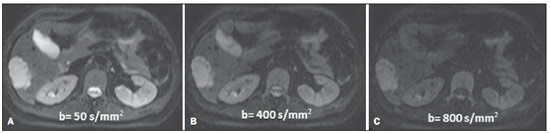 Figura 3. Imagens ponderadas em difusão com diferentes valores de b de paciente do sexo feminino, 47 anos, com hemangioma hepático na transição dos segmentos V e VI. A imagem com o valor de b 50 s/mm2 é mais "anatômica", com atenuação dos efeitos da perfusão, ou seja, com atenuação dos vasos e do liquor (A). Já nas imagens com b mais alto (B,C) observa-se, progressivamente, atenuação da intensidade do sinal dos tecidos normais, entretanto, o hemangioma persiste com alto sinal (tecido com maior celularidade / efeito T2). Cortesia do Dr. Gustavo Luersen – Hospital Moinhos de Vento, Porto Alegre, RS. 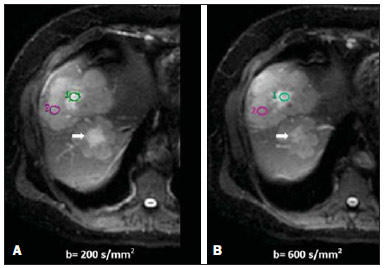 Figura 4. Esta figura mostra metástases hepáticas de paciente de 66 anos portadora de adenocarcinoma de cólon, em tratamento com droga antiangiogênica bevacizumabe. Observam-se as imagens ponderadas em difusão com diferentes valores de b, sendo 200 s/mm2 (A) e 600 s/mm2 (B). O centro necrótico das lesões metastáticas (ROI verde e seta branca) mostra a atenuação da intensidade do sinal, com valores de b crescentes, indicando menor restrição à difusão. Em comparação, a periferia do tumor (ROI roxo) apresenta maior celularidade e mostra pouca atenuação do sinal com o aumento do valor de b. Ao empregar diferentes valores b, também é possível realizar uma análise quantitativa pela imagem de difusão. Esta análise é usualmente realizada na estação de trabalho através do cálculo dos valores do ADC (Figura 5). O ADC é independente da intensidade do campo magnético e pode superar os "efeitos T2", permitindo assim uma comparação mais significativa dos resultados. O ADC é calculado para cada pixel da imagem e é exibido como um mapa paramétrico. Áreas de restrição à difusão de moléculas de água demonstram elevado sinal em DWI e baixos valores no mapa de ADC; é o que chamamos de correspondência no mapa ADC (Figura 6). 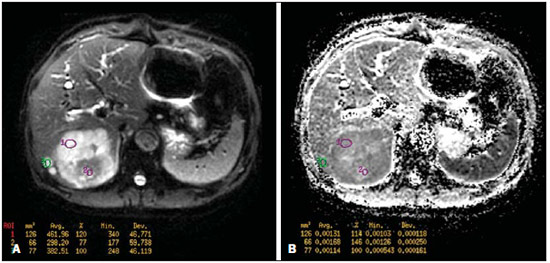 Figura 5. Análise quantitativa da DWI. Paciente do sexo masculino, 70 anos, apresentando lesão heterogênea nos segmentos hepáticos VI/VII, com pequenas lesões satélites. Em A, imagem ponderada em difusão (b = 600 s/mm2) demonstra alto sinal na periferia da lesão dominante (ROI 1 – roxo), baixo sinal central (ROI 2 – roxo) e alto sinal nas lesões satélites (ROI 3 – verde). Em B, mapa de ADC demonstra correspondência à DWI, com baixos valores na ROI 1 (1,3 × 10–3) e na ROI 3 (1,1 × 10–3) e valor mais alto na ROI 2 (1,7 × 10–3). O anatomopatológico confirmou a heterogeneidade do tumor, um colangiocarcinoma moderadamente diferenciado com áreas de necrose. 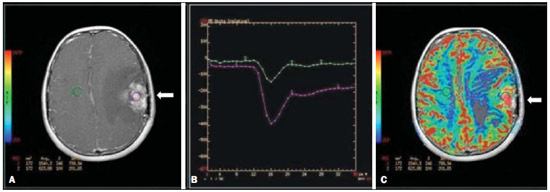 Figura 6. RM dinâmica (DSC-RM) de tumor neuroglial de alto grau (seta) em paciente de 16 anos. Em A, imagem axial T1 pós-gadolínio mostra duas ROIS: 1 (roxo) na lesão tumoral e 2 (verde) em tecido normal. Em B, as respectivas curvas de intensidade de sinal em função do tempo revelam maior perfusão na região do tumor em relação ao tecido normal (> 2,0). Em C, a imagem rBV sobreposta na imagem axial T1 pós-contraste demonstra aumento da perfusão na ROI tumoral (seta). PERFUSÃO Boa parte das técnicas de imagem molecular utiliza marcadores exógenos que produzem o sinal da imagem ou do contraste. O marcador, por exemplo, pode ser um meio de contraste intravenoso convencional como o agente gadolínio. Uma evolução do emprego destes agentes ocorreu com o advento do estudo dinâmico com contraste (DCE) ou perfusão por RM. Nestas técnicas, as imagens são adquiridas sequencialmente durante a passagem do agente de contraste pelo tecido de interesse e têm sido utilizadas na caracterização de lesões de diferentes sítios anatômicos, incluindo lesões cerebrais, mamárias, ginecológicas e prostáticas. Não são métodos intrinsecamente moleculares, mas possibilitam a avaliação indireta de processos moleculares que influenciam o fluxo sanguíneo(13). A análise quantitativa e qualitativa dinâmica do contraste por RM também pode ser útil na diferenciação dos tumores benignos e malignos do sistema musculoesquelético(14). Atualmente, encontra-se disponível uma técnica de perfusão por RM bastante promissora, sem o emprego do contraste paramagnético. Esta técnica vem sendo utilizada na avaliação do fluxo sanguíneo cerebral, conhecida como arterial spin labeling, disponível, por enquanto, em centros mais avançados(15). A técnica de RM dinâmica convencional se baseia no conceito de formação de novos vasos (angiogênese) associada a um fluxo sanguíneo e permeabilidade aumentados, condições essenciais para a disseminação metastática das neoplasias malignas(14,16,17). A composição microvascular no interior do tumor é relevante fator prognóstico, e a RM, por meio da sequência de perfusão, é capaz de fornecer informações sobre esta característica de forma não invasiva(13). Comumente, as imagens são obtidas após infusão de gadolínio de baixo peso molecular. A distribuição do contraste nos meios intra e extravasculares irá depender de fatores como fluxo sanguíneo, permeabilidade vascular e capacidade de difusão no interstício. Esta técnica pode ser obtida por gradienteeco T1 (GRE-T1) e T2*(13,14). As sequências GRE-T1 caracterizam, de forma mais apropriada, as mudanças de permeabilidade e o extravasamento para o espaço extravascular e são indicadas para a avaliação de regiões extracranianas. As sequências T2* são indicadas mais frequentemente para a avaliação cerebral e determinam o volume sanguíneo e a perfusão tecidual capilar (Figura 6). Com essas sequências é possível realizar medidas qualitativas, semiquantitativas e quantitativas(13,14). As medidas qualitativas podem ser obtidas pela confecção de curvas de intensidade de sinal versus tempo, bastante empregadas na avaliação do carcinoma mamário (Figura 7). As medidas semiquantitativas se relacionam com as diferenças de intensidade de sinal antes e após a infusão do meio de contraste (intensidade de sinal relativa). Nas medidas quantitativas existem modelos farmacocinéticos que possibilitam a obtenção dos dados. Desta forma, é possível criar mapas paramétricos coloridos que demonstram o comportamento tumoral, importante, por exemplo, para o planejamento terapêutico(13,14,16) (Figura 6). 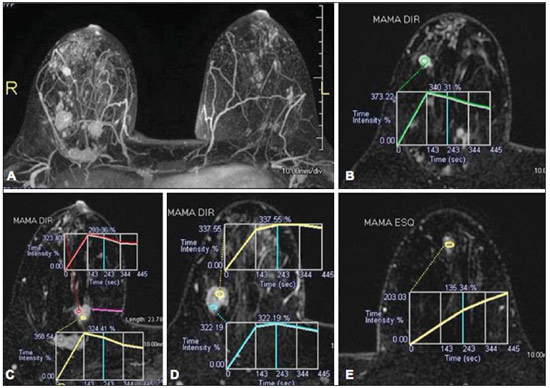 Figura 7. Paciente de 30 anos com carcinoma ductal invasivo multicêntrico na mama direita e fibroadenoma na mama esquerda. Em A observa-se imagem contrastada dinâmica mamária bilateral em 3D MIP com subtração, demonstrando múltiplos nódulos mamários à direita e um nódulo retroareolar à esquerda. Em B, C e D observa-se que o padrão de realce dos nódulos mamários à direita demonstra características de curvas do tipo washout e platô tipo 3, podendo ser encontrado em nódulos malignos. Em E, a análise da curva cinética do nódulo mamário à esquerda demonstra característica diferente dos demais, mostrando curva do tipo 1, padrão mais frequente em nódulos benignos. Cortesia do Dr. Almir Galvão Vieira Bitencourt – A.C.Camargo Cancer Center, São Paulo, SP. As informações fornecidas pela RM dinâmica podem ser empregadas com diferentes finalidades. Esta avaliação pode ocorrer em diferentes etapas, incluindo o diagnóstico, o estadiamento e a avaliação de resposta, sobretudo quando se utilizam drogas antiangiogênicas(14,16). Dados da literatura também atribuem um papel relevante da perfusão como fator prognóstico e na avaliação de recorrência. Em diferentes tipos de tumores a perfusão tem sido empregada como fator preditor de resposta e como um biomarcador da hipóxia tumoral, sobretudo em tumores bem vascularizados, como os de pulmão, colo de útero, cabeça e pescoço, mama, fígado, musculoesquelético e colorretal(14,16,17). Entretanto, a existência de proeminente realce pós-contraste ao fim do tratamento pode estar associada a doença localmente agressiva, com redução das taxas de sobrevida. Os estudos de angiogênese têm evoluído continuamente nos últimos anos. O advento de contrastes constituídos por macromoléculas permite a manutenção destes agentes por mais tempo no espaço intravascular. Os meios de contaste que possuem o ácido gadoxético são exemplos destes agentes na caracterização de lesões focais hepáticas. O desenvolvimento de substâncias direcionadas contra moléculas expressas por vasos neoangiogênicos, como o fator de crescimento endotelial vascular, é outra possibilidade de incremento no manejo de contrastes pela técnica de perfusão(16,17). ESPECTROSCOPIA A espectroscopia por RM (RMS) avalia a distribuição e níveis de metabólitos normalmente encontrados nos tecidos saudáveis e o aumento dos metabólitos habitualmente detectado nos tecidos tumorais(18). Creatina, colina, lactato, citrato, N-acetilaspartato e adenosina trifosfato são exemplos de metabólitos alterados comumente encontrados(19). Esta técnica costuma ser indicada, por exemplo, na avaliação de lesões mamárias, prostáticas e cerebrais(18-20). Dentre as principais indicações estão a caracterização da lesão, a seleção de área para biópsia e a avaliação de resposta terapêutica. Esta técnica costuma ser empregada na avaliação de lesões cerebrais. O aumento dos níveis de colina (considerado um marcador de proliferação celular), associado a redução dos níveis de creatina (considerado marcador de processos energéticos) e a redução dos níveis de N-acetilaspartato (considerado marcador neuronal), tem sido encontrado na avaliação de neoplasias cerebrais. Através da combinação destes níveis é possível realizar, por exemplo, a distinção entre gliomas de baixo e de alto grau(18,19) (Figura 8). A combinação da RM convencional e RMS também aumenta em até 20% a capacidade de determinar o tipo e o grau do tumor cerebral. É capaz de diferenciar tumores viáveis de áreas de necrose, contribuindo na avaliação da resposta tumoral. Habitualmente, na vigência de resposta ocorre uma diminuição nos picos de colina e N-acetilaspartato, associada a um aumento nos níveis de lipídios e lactato (marcadores anaeróbios)(19). 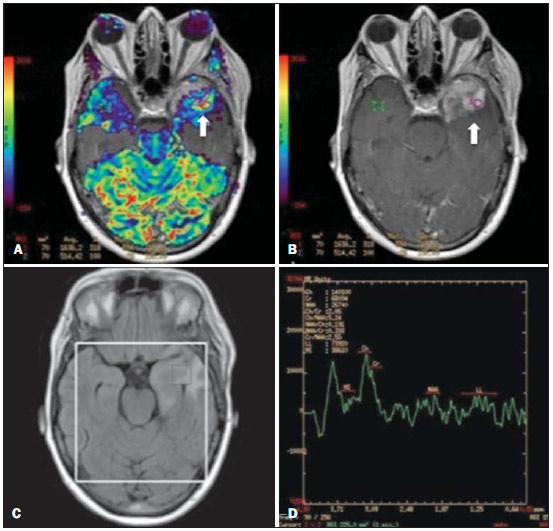 Figura 8. Paciente do sexo feminino, 55 anos, ressecção de tumor (glioblastoma multiforme) no lobo temporal esquerdo há seis meses, em tratamento com radioterapia e temodal. Solicitado exame com técnicas avançadas de RM para diagnóstico diferencial entre recidiva e radionecrose de área de realce pós-gadolínio no leito cirúrgico. Em A observa-se imagem ponderada em T1 pós-contraste demonstrando área de realce na cavidade cirúrgica (seta). Em B observa-se aumento da perfusão (seta) no mapa rBV (a ROI desta área, comparada com uma área de substância branca normal contralateral, apresenta relação > 2,6, valor que tem sido proposto para recidiva tumoral). Em C e D, o estudo de espectroscopia demonstra redução do pico do metabólito N-acetilaspartato (NAA) e aumento do pico de colina (Cho), corroborando o diagnóstico. Cortesia do Dr. Leonardo Vedolin – Hospital Moinhos de Vento, Porto Alegre, RS. Na avaliação de lesões mamárias, por exemplo, um pico combinado de colina pode ser detectado nas lesões malignas. Ao contrário, nas lesões benignas ou no tecido mamário normal, os níveis encontrados são baixos ou indetectáveis. Entretanto, ainda existem alguns fatores limitantes no emprego desta técnica que devem ser ressaltados. Na avaliação de lesões inferiores a 2 cm, em mulheres lactantes (devido à existência de um pico de colina no tecido mamário normal) ou na avaliação de algumas lesões benignas como o adenoma tubular, esta técnica pode apresentar resultados discordantes que devem ser confrontados com outros exames(20). Na avaliação prostática a espectroscopia obtém dados metabólicos baseados na concentração relativa dos metabólitos endógenos como colina, creatina, citrato e, mais recentemente, poliamina(21). Os valores absolutos dos níveis de citrato, creatina e colina contribuem na identificação de áreas suspeitas de malignidade, e a relação colina + creatina/citrato demonstra equivalência com o escore de Gleason, possibilitando de forma não invasiva a seleção de áreas para biópsia da glândula e a avaliação do grau tumoral(21,22). Deste modo, a espectroscopia pode ser empregada no diagnóstico de recorrência tumoral em pacientes tratados por radioterapia, crioterapia ou por cirurgia(21-23). Ainda é discutível o emprego rotineiro da espectroscopia na avaliação de outras neoplasias (Figura 9). 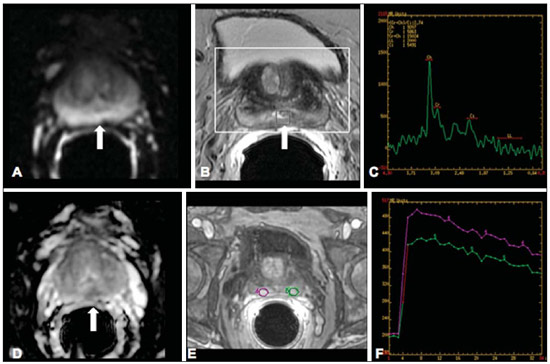 Figura 9. Em A, DWI (b = 1000 s/mm2) com alto sinal na região medial das 5 às 7 horas (seta) na zona periférica. Em B, imagem ponderada em T2 demonstra tênue área mal definida (seta). Na espectroscopia (C) observa-se aumento do pico de colina, com redução do pico de citrato (relação colina + creatina/citrato = 2,7) na área demonstrada pela ROI da imagem em B. Em D, o mapa de ADC demonstra a mesma área com baixo do sinal (seta) às 6 horas na zona periférica. Em E, a imagem contrastada dinâmica demonstra realce na região medial (das 5 às 7 horas). Em F, a curva cinética apresenta intenso e precoce realce (washin), tendendo ao rápido clareamento (washout). Estes parâmetros representam área suspeita para malignidade. RM DE CORPO INTEIRO As modalidades de imagem do corpo inteiro vêm sendo empregadas na avaliação do paciente com câncer há algum tempo(24). Nos últimos 10 anos, a tomografia por emissão de pósitrons/tomografia computadorizada (PET/CT) consagrou-se como uma ferramenta que melhorou o desempenho de avaliação clínica dos pacientes oncológicos, proporcionando uma avaliação mais adequada, permitindo a escolha da opção terapêutica mais apropriada(25). Por outro lado, o desenvolvimento de novas sequências de RM vem aprimorando o uso desta ferramenta na avaliação dos pacientes oncológicos(26). O advento de técnicas ecoplanares permitiu a realização de imagens do corpo inteiro por meio desta técnica nas diferentes sequências, tais como T1, T2, STIR e difusão. O melhor controle dos efeitos artefatuais dos movimentos fisiológicos cardíacos e respiratórios permitiu o fornecimento de imagens de boa qualidade e que complementam as informações morfológicas habitualmente fornecidas pelas técnicas convencionais de RM (Figura 10)(26). 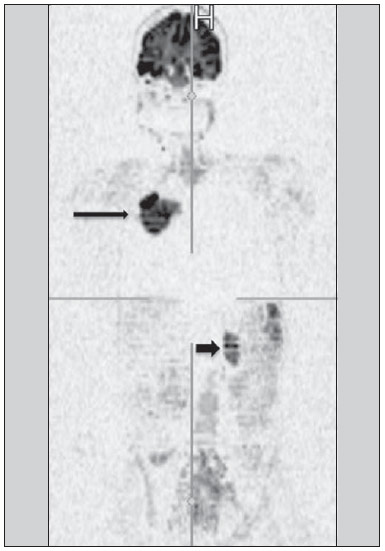 Figura 10. A RMCI é útil na detecção de metástases, especialmente em lesões do cérebro, fígado e ossos. Nesta figura, uma paciente do sexo feminino de 65 anos com adenocarcinoma de pulmão no lobo superior direito (seta longa) com metástase para a glândula adrenal esquerda (seta curta). A RMCI no plano coronal demonstra as lesões na sequência de difusão. A RM de corpo inteiro (RMCI) é uma técnica não invasiva, isenta dos riscos da radiação ionizante e com alta resolução para tecidos de partes moles, que rapidamente adquire imagens do corpo inteiro. Durante o exame, o corpo é dividido em diferentes porções e as imagens são adquiridas em cortes axiais e coronais(26). A técnica da difusão pode ser aplicada a fim de se obter imagem com supressão de sinal do corpo. Desta maneira, muitos órgãos têm seu sinal removido e as áreas de tumor com difusão são identificadas como áreas de intenso brilho ou elevado sinal(27,28). Estudos da literatura têm demonstrado que a RMCI é superior à cintilografia na detecção de metástases ósseas, pois permite a visualização da infiltração da medula óssea, ao passo que a cintilografia óssea detecta apenas atividade osteoblástica(28-30). É um método bastante sensível na avaliação de lesões ósseas do mieloma múltiplo, visto que permite avaliar diretamente o envolvimento da medula óssea pelo tumor. Costuma ser mais sensível que a tomografia na avaliação da atividade da doença. Além disso, pode ser utilizada para monitorar a efetividade do tratamento e tem valor em predizer a resposta ao tratamento e a sobrevida(31). No estadiamento TNM, o exame de PET/CT tem se mostrado bastante preciso na avaliação de diversos tipos de tumores, sobretudo carcinoma broncogênico, linfomas e tumores colorretais(32). A RMCI, por sua vez, também é bastante útil na detecção de metástases a distância, especialmente para o cérebro, fígado e sistema musculoesquelético (Figura 11)(33). Esta ferramenta pode ser utilizada para avaliar pacientes com metástase sem tumor primário conhecido e ser uma boa alternativa, devido à ausência de exposição à radiação na detecção precoce de tumores em indivíduos assintomáticos, quando a doença ainda é curável(34). 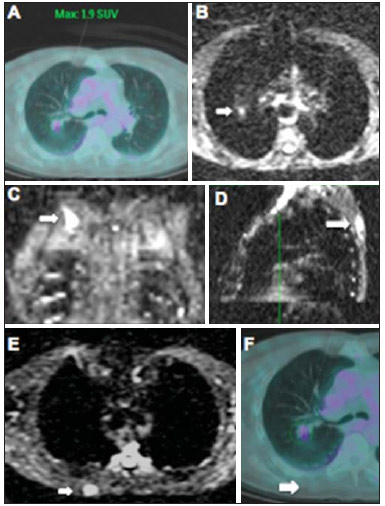 Figura 11. Paciente do sexo masculino, 69 anos, com nódulo sólido, espiculado no lobo superior direito detectado incidentalmente no exame radiográfico e com diagnóstico histológico de adenocarcinoma. No exame de PET/CT (A) havia apenas captação anormal de FDG na lesão, sem sinais de metástases intratorácicas ou a distância. O exame de RMCI (B) demonstrou hipersinal irregular na lesão pulmonar e na região da musculatura dorsal, identificado em C, D e E, este último não evidenciado pelo PET/CT (F). A biópsia confirmou o diagnóstico de metástase de adenocarcinoma pulmonar. Entretanto, há algumas limitações deste método, como, por exemplo, as contraindicações à exposição ao campo magnético. Atualmente, as limitações da avaliação do parênquima pulmonar e o longo período do exame estão sendo contornados com a evolução dos equipamentos e o desenvolvimento de novas técnicas. Hoje é possível realizar um exame de RMCI em cerca de 30 minutos, com satisfatória resolução das estruturas torácicas e com capacidade de rastreamento de lesões periféricas. Alguns estudos demonstram resultados equivalentes aos resultados obtidos com o exame de PET/CT(32-34). Além disso, a RMCI pode se tornar uma ferramenta útil nos pacientes que não desejam ser submetidos a radiação ionizante ou nos pacientes cujos efeitos da radiação podem trazer graves danos, como nos casos de gestantes, crianças ou pacientes expostos repetitivamente ao longo do tratamento(35). Sequências de imagens e técnicas na RMCI Não há consenso atual sobre qual combinação de sequências fornece a maior acurácia na RMCI, mantendo a eficiência de tempo razoável(36). No entanto, os seguintes tipos de sequências são normalmente utilizados: 1 - Short tau invertion recovery (STIR): Esta é a sequência mais utilizada em RMCI. Uma sequência STIR rápida com uma duração típica de trem-de-eco entre 16 e 30 pode ser usada sozinha ou em combinação com outros tipos de sequências(37). As vantagens da imagem STIR incluem o fato de que a maioria dos tecidos patológicos é rica em prótons e apresenta tempos prolongados de T1 e tempo prolongado de relaxação T2, com consequente alta intensidade de sinal em STIR(38). A supressão de gordura em imagens STIR é mais forte e homogênea do que em imagens de saturação de gordura saturadas em T2. As sequências STIR aplicadas no plano coronal podem ser as únicas sequências utilizadas em um exame de corpo inteiro pela RM, mas têm representação limitada do esterno, das costelas, da escápula e do crânio(38). A RM no plano coronal geralmente é menos sensível do que a RM no plano axial para detecção de doença linfonodal(39). 2 - T1 spin eco rápido: Esta sequência pode ser aplicada no plano coronal, juntamente com a sequência STIR para alcançar uma maior especificidade na detecção de anormalidades da medula. Imagens coronais rápidas ponderadas em T1 spin eco são particularmente úteis para avaliar as alterações da medula gordurosa após a terapia de radiação e as lesões metastáticas na medula gordurosa(40). 3 - Sequência ponderada em T1 com aquisições antes e após o uso do meio de contraste. De acordo com alguns autores, esta sequência deve ser a base de todos os protocolos de imagem de RMCI(41). Se optado pelo uso de contraste, uma região pode ser estudada em uma única pausa respiratória. O fígado, por exemplo, pode ser avaliado nas fases arterial e venosa. Ao término, o resto do corpo pode ser avaliado no rastreamento de lesões metastáticas(42). O uso de um material à base de gadolínio melhora a sensibilidade, especificidade e acurácia diagnóstica. O seu emprego facilita a combinação de estadiamento local e avaliação de doença metastática no mesmo exame. 4 - Sequência single-shot: A aplicação desta sequência em ambos os planos, axial e coronal, pode ser útil quando a presença de doença gastrintestinal é conhecida ou suspeita. Apresenta um tempo de aquisição curto e pode ser facilmente incorporada no protocolo de RMCI, sem comprometer a eficiência do tempo. 5 - Sequência em estado de precessão livre: Uma sequência de imagens rápida como esta foi utilizada para detectar metástases hepáticas e pulmonares com diâmetros superiores a 8 mm, em um pequeno estudo que incluiu apenas cinco pacientes(43). Este tipo de sequência fornece boa informação morfológica e delineia vasos com boa acurácia. As imagens de RMCI do tórax e abdome apresentam desafios especiais por causa do movimento respiratório do paciente e movimentos peristálticos do intestino. As imagens torácicas e abdominais podem ser obtidas por meio de técnicas de compensação respiratória com aumento do tempo de aquisição. Para reduzir a motilidade intestinal, antiperistálticos podem ser injetados por via intravenosa. Cabe ressaltar que se o abdome ou o tórax é o local de um tumor primário ou de uma área de neoplasia, as imagens de RMCI são geralmente realizadas em combinação com um protocolo de imagem dedicado, que inclui a utilização de técnicas de compensação respiratória e às vezes a administração de antiperistálticos. PET/RM O emprego contínuo do exame de PET/CT em oncologia, assim como o advento das técnicas de RMCI, fez com que a fusão das imagens obtidas por estas ferramentas (Figura 12) ou a confecção de equipamentos híbridos de PET/RM fossem desenvolvidas nas últimas duas décadas(44,45). Uma limitação que prejudicava a associação destas duas modalidades em um mesmo equipamento era o fato de os fotomultiplicadores utilizados nos equipamentos de PET não apresentarem funcionamento adequado no interior ou próximo do campo magnético. Outra limitação era a presença de materiais metálicos nas bobinas de superfície, promovendo interferência nos raios gama e atenuação indesejada no PET/CT(46). Entretanto, com a evolução tecnológica, algumas destas barreiras foram ultrapassadas e os primeiros equipamentos para utilização clínica foram disponibilizados a partir de 2012(47). 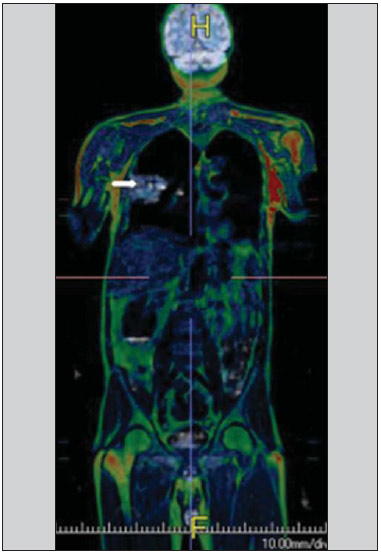 Figura 12. Paciente masculino, 71 anos, portador de carcinoma de células escamosas do lobo superior direito, sem sinais de lesões metastáticas no exame de PET/RM. Neste caso houve a fusão dos planos anatômicos coronais da RM ponderada em T1 com a imagem funcional adquirida com o FDG-PET/CT. As aplicações clínicas da PET/RM encontram-se em contínua pesquisa e avanços nesta área têm sido documentados. Dados publicados recentemente sugerem que a PET/RM agrega maior valor na avaliação dos pacientes oncológicos. Algumas vantagens específicas são atribuídas ao PET/CT na detecção de metástases ósseas e de linfonodos e ao exame de RM na detecção de metástases cerebrais e hepáticas(47). Ou seja, a vantagem de se estudar o corpo inteiro em um único momento, de forma ampla e abrangente, justificaria o uso combinado destas ferramentas. Entretanto, um consenso sobre as indicações e reais benefícios na prática clínica ainda necessita ser estabelecido. CONCLUSÃO Atualmente, vivenciamos a era do tratamento individualizado, em que fatores genéticos e intrínsecos tumorais acabam sendo decisivos na evolução da doença e conduta terapêutica. A avaliação de parâmetros funcionais pela RM vem ganhando cada vez mais espaço na avaliação dos pacientes oncológicos por permitir melhor compreensão da complexidade tumoral e do acompanhamento terapêutico, impactando positivamente no manejo deste grupo de pacientes. REFERÊNCIAS 1. Serkova NJ, Garg K, Bradshaw-Pierce EL. Oncologic imaging endpoints for the assessment of therapy response. Recent Pat Anticancer Drug Discov. 2009;4:36–53. 2. Bragg DG. State-of-the-art assessment. Diagnostic oncologic imaging. Cancer. 1989;64(1 Suppl):261–5. 3. Chojniak R. Imagem em oncologia no CBR. Radiol Bras. 2011;44(3):v. 4. Atri M. New technologies and directed agents for applications of cancer imaging. J Clin Oncol. 2006;24:3299–308. 5. Clarke LP, Croft BS, Nordstrom R, et al. Quantitative imaging for evaluation of response to cancer therapy. Transl Oncol. 2009;2:195–7. 6. González Hernando C, Esteban L, Cañas T, et al. The role of magnetic resonance imaging in oncology. Clin Transl Oncol. 2010;12:606–13. 7. Higgins LJ, Pomper MG. The evolution of imaging in cancer: current state and future challenges. Semin Oncol. 2011;38:3–15. 8. Histed SN, Lindenberg ML, Mena E, et al. Review of functional/anatomical imaging in oncology. Nucl Med Commun. 2012;33:349–61. 9. Padhani AR. Diffusion magnetic resonance imaging in cancer patient management. Semin Radiat Oncol. 2011;21:119–40. 10. Koh DM, Takahara T, Imai Y, et al. Practical aspects of assessing tumors using clinical diffusion-weighted imaging in the body. Magn Reson Med Sci. 2007;6:211–24. 11. Padhani AR, Koh DM. Diffusion MR imaging for monitoring of treatment response. Magn Reson Imaging Clin N Am. 2011;19:181–209. 12. Testa ML, Chojniak R, Sene LS, et al. Ressonância magnética com difusão: biomarcador de resposta terapêutica em oncologia. Radiol Bras. 2013;46:178–80. 13. Zweifel M, Padhani AR. Perfusion MRI in the early clinical development of antivascular drugs: decorations or decision making tools? Eur J Nucl Med Mol Imaging. 2010;37 Suppl 1:S164–82. 14. Costa FM, Vianna EM, Domingues RC, et al. Espectroscopia de prótons e perfusão por ressonância magnética na avaliação dos tumores do sistema musculoesquelético. Radiol Bras. 2009;42:215–23. 15. Gonçalves FG, Maldjian JA. Novidades em radiologia – Arterial spin labeling, a perfusão por RM sem contraste. Radiol Bras. 2011;44(1):ix–xi. 16. Harry VN, Semple SI, Parkin DE, et al. Use of new imaging techniques to predict tumour response to therapy. Lancet Oncol. 2010;11:92–102. 17. Kwee TC, Takahara T, Klomp DW, et al. Cancer imaging: novel concepts in clinical magnetic resonance imaging. J Intern Med. 2010;268:120–32. 18. Porto L, Kieslich M, Franz K, et al. MR spectroscopy differentiation between high and low grade astrocytomas: a comparison between paediatric and adult tumours. Eur J Paediatr Neurol. 2011;15:214–21. 19. Kauppinen RA, Peet AC. Using magnetic resonance imaging and spectroscopy in cancer diagnostics and monitoring: preclinical and clinical approaches. Cancer Biol Ther. 2011;12:665–79. 20. Baltzer PA, Dietzel M. Breast lesions: diagnosis by using proton MR spectroscopy at 1.5 and 3.0 T – systematic review and meta-analysis. Radiology. 2013;267:735–46. 21. Baroni RH, Novis MI, Caiado AHM, et al. Ressonância magnética da próstata: uma visão geral para o radiologista. Radiol Bras. 2009;42:185–92. 22. Boonsirikamchai P, Choi S, Frank SJ, et al. MR imaging of prostate cancer in radiation oncology: what radiologists need to know. Radiographics. 2013;33:741–61. 23. Goldman SM. Ressonância magnética da próstata. Radiol Bras. 2009;42(3):vii–viii. 24. Martí-Bonmatí L, Sopena R, Bartumeus P, et al. Multimodality imaging techniques. Contrast Media Mol Imaging. 2010;5:180–9. 25. Griffeth LK. Use of PET/CT scanning in cancer patients: technical and practical considerations. Proc (Bayl Univ Med Cent). 2005;18:321–30. 26. Carty F, Shortt CP, Shelly MJ, et al. Whole-body imaging modalities in oncology. Semin Musculoskelet Radiol. 2010;14:68–85. 27. Koh DM, Blackledge M, Padhani AR, et al. Whole-body diffusionweighted MRI: tips, tricks, and pitfalls. AJR Am J Roentgenol. 2012;199:252–62. 28. Koh DM, Collins DJ. Diffusion-weighted MRI in the body: applications and challenges in oncology. AJR Am J Roentgenol. 2007;188:1622–35. 29. Tan CH, Wei W, Johnson V, et al. Diffusion-weighted MRI in the detection of prostate cancer: meta-analysis. AJR Am J Roentgenol. 2012;199:822–9. 30. Takenaka D, Ohno Y, Matsumoto K, et al. Detection of bone metastases in non-small cell lung cancer patients: comparison of wholebody diffusion-weighted imaging (DWI), whole-body MR imaging without and with DWI, whole-body FDG-PET/CT, and bone scintigraphy. J Magn Reson Imaging. 2009;30:298–308. 31. Padhani AR, Khan AA. Diffusion-weighted (DW) and dynamic contrast-enhanced (DCE) magnetic resonance imaging (MRI) for monitoring anticancer therapy. Target Oncol 2010;5:39–52. 32. Komori T, Narabayashi I, Matsumura K, et al. 2-[fluorine-18]-fluoro-2-deoxy-D-glucose positron emission tomography/computed tomography versus whole-body diffusion-weighted MRI for detection of malignant lesions: initial experience. Ann Nucl Med. 2007;21:209–15. 33. Heusner TA, Kuemmel S, Koeninger A, et al. Diagnostic value of diffusion-weighted magnetic resonance imaging (DWI) compared to FDG PET/CT for whole-body breast cancer staging. Eur J Nucl Med Mol Imaging. 2010;37:1077–86. 34. Guimaraes MD, Chojniak R. Molecular imaging enhances diagnostic and management targets in patients with cancer of unknown primary site. AJR Am J Roentgenol. 2013;201:W919. 35. Davies HE, Wathen CG, Gleeson FV. The risks of radiation exposure related to diagnostic imaging and how to minimise them. BMJ. 2011;25;342:d947. 36. Mazumdar A, Siegel MJ, Narra V, et al. Whole-body fast inversion recovery MR imaging of small cell neoplasms in pediatric patients: a pilot study. AJR Am J Roentgenol. 2002;179:1261–6. 37. Kellenberger CJ, Epelman M, Miller SF, et al. Fast STIR wholebody MR imaging in children. Radiographics. 2004;24:1317–30. 38. Darge K, Jaramillo D, Siegel MJ. Whole-body MRI in children: current status and future applications. Eur J Radiol. 2008;68:289– 98. 39. Hirsch W, Krohmer S, Kluge R, et al. Preliminary results in wholebody MRI in children – a prospective study [abstract]. Pediatr Radiol. 2005;35(Suppl):S89. 40. Krohmer S, Sorge I, Krausse A, et al. Whole-body MRI for primary evaluation of malignant disease in children. Eur J Radiol. 2010;74:256–61. 41. Lauenstein TC, Semelka RC. Emerging techniques: whole-body screening and staging with MRI. J Magn Reson Imaging. 2006;24:489–98. 42. Lauenstein TC, Goehde SC, Herborn CU, et al. Whole-body MR imaging: evaluation of patients for metastases. Radiology. 2004;233:139–48. 43. Barkhausen J, Quick HH, Lauenstein T, et al. Whole-body MR imaging in 30 seconds with real-time true FISP and a continuously rolling table platform: feasibility study. Radiology. 2001;220:252–6. 44. Schwenzer NF, Pfannenberg C, Reischl G, et al. Application of MR/PET in oncologic imaging. Rofo. 2012;184:780–7. 45. Werner MK, Schmidt H, Schwenzer NF. MR/PET: a new challenge in hybrid imaging. AJR Am J Roentgenol. 2012;199:272–7. 46. Vaska P, Cao T. The state of instrumentation for combined positron emission tomography and magnetic resonance imaging. Semin Nucl Med. 2013;43:11–8. 47. von Schulthess GK, Kuhn FP, Kaufmann P, et al. Clinical positron emission tomography/magnetic resonance imaging. Semin Nucl Med. 2013;43:3–10. 1. Mestre e Doutorando, Médico Radiologista Especialista em Imagem do Tórax e Imagem Oncológica, Preceptor do Hospital Heliópolis e do A.C.Camargo Cancer Center, São Paulo, SP, Brasil 2. Membro Titular do Colégio Brasileiro de Radiologia e Diagnóstico por Imagem (CBR), Especialista em Imagem em Oncologia, Médica Radiologista do Hospital Moinhos de Vento, Porto Alegre, RS, Brasil 3. Pós-Doutorado, Médico Radiologista da Universidade Federal de Ciências da Saúde de Porto Alegre (UFCSPA), Porto Alegre, RS, Brasil 4. Doutor, Médico Cirurgião Oncológico, Chefe do Departamento de Cirurgia Torácica do A.C.Camargo Cancer Center, São Paulo, SP, Brasil 5. Doutor, Diretor do Departamento de Imagem do A.C.Camargo Cancer Center, São Paulo, SP. Brasil 6. Doutor, Professor Titular da Universidade Federal Fluminense (UFF), Niterói, RJ, Professor Associado da Universidade Federal do Rio de Janeiro (UFRJ), Rio de Janeiro, RJ, Brasil Endereço para correspondência: Dr. Marcos Duarte Guimaraes Rua Paulo Orozimbo, 726, Cambuci São Paulo, SP, Brasil, 01535-001 E-mail: marcosduarte500@gmail.com Recebido para publicação em 27/5/2013. Aceito, após revisão, em 17/9/2013. Trabalho realizado no Departamento de Imagem do A.C.Camargo Cancer Center, São Paulo, SP, Brasil. |
|
Av. Paulista, 37 - 7° andar - Conj. 71 - CEP 01311-902 - São Paulo - SP - Brazil - Phone: (11) 3372-4544 - Fax: (11) 3372-4554