Radiologia Brasileira - Publicação Científica Oficial do Colégio Brasileiro de Radiologia
AMB - Associação Médica Brasileira CNA - Comissão Nacional de Acreditação
 Vol. 47 nº 4 - Jul. / Ago. of 2014
Vol. 47 nº 4 - Jul. / Ago. of 2014
|
ARTIGO DE REVISÃO
|
|
|
|
|
Autho(rs): Denise Joffily Pereira da Costa Pinheiro1; Simone Elias2; Afonso Celso Pinto Nazário3 |
|
|
Descritores: Câncer de mama; Linfonodos axilares; Ultrassonografia; Aspectos morfológicos. |
|
|
Resumo: INTRODUÇÃO
A presença ou não de doença metastática nos linfonodos da cadeia regional é informação fundamental para definir estadiamento, tratamento e prognóstico do câncer de mama. O método padrão ouro para avaliação desses linfonodos ainda é a linfonodectomia axilar com análise histológica, entretanto, este método se associa a morbidade relevante. Com os avanços no diagnóstico da imaginologia mamária e o consequente aumento da incidência de casos em estágios iniciais, a presença de metástase em linfonodos axilares declinou, fazendo-se necessária uma alternativa menos agressiva. A técnica de biópsia do linfonodo sentinela (BLS), praticada inicialmente por Krag em 1993(1), surgiu como um grande avanço no tratamento de pacientes com axila clinicamente negativa, obtendo atualmente menos de 1% de recorrência axilar em pacientes com BLS negativa(2). Na metanálise de Kell et al., a BLS mostrou-se equivalente ao esvaziamento axilar na detecção de metástases em linfonodos regionais e com até 75% menos morbidade nas pacientes em estádio inicial(3). O esvaziamento axilar seguido do resultado positivo para metástase na BLS apresentou, segundo estudos, de 38% a 67% de ausência de metástase nos demais linfonodos(4). Este dado levantou a questão sobre qual seria o verdadeiro benefício da dissecção ampla de linfonodos quando o sentinela se apresenta comprometido. Esse benefício é particularmente desconhecido nos casos de micrometástases e células tumorais isoladas, de significado clínico ainda indeterminado. Os estudos a respeito ainda são controversos, e no momento a maioria dos serviços mantém a abordagem axilar ampla mesmo em casos de mínimo comprometimento do linfonodo sentinela(5). A identificação de novos marcadores prognósticos, a melhor compreensão do comportamento tumoral e o avanço tecnológico na área da imagem guardam grande potencial para modificar a conduta axilar no futuro, selecionando pacientes candidatas a intervenção menos agressiva. Recentemente, o estudo ACOSOG Z0011 estabeleceu o perfil de um grupo de pacientes candidatas a não dissecção da cadeia axilar após uma BLS positiva(6). Esse protocolo é adotado pela Disciplina de Mastologia da Escola Paulista de Medicina da Universidade Federal de São Paulo desde novembro de 2012. Exame clínico e mamografia comprovadamente não apresentam acurácia adequada na identificação de metástases em linfonodos axilares(7), e diversos estudos abordam outras técnicas de imagem, entre elas: ultrassonografia isolada ou associada a dopplerfluxometria; punção aspirativa por agulha fina (PAAF) ou por agulha grossa (core biópsia); tomografia computadorizada; tomografia por emissão de pósitrons; ressonância magnética; elastografia. Atualmente, nenhum exame de imagem possui valor preditivo negativo suficiente para evitar abordagem cirúrgica da axila quando nenhum linfonodo alterado é identificado(8), todavia, cada vez mais estudos incluem esses métodos como parte do planejamento terapêutico. No Instituto Europeu de Oncologia está em andamento um estudo que compara a BLS versus apenas observação, quando a ultrassonografia axilar não apresenta alterações, em pacientes com estádio clínico inicial e candidatas a cirurgia conservadora da mama(9). A ultrassonografia axilar possui papel de destaque no estadiamento e seguimento dos linfonodos regionais. É um exame não invasivo, de fácil acesso e que ainda auxilia a captação de material para citologia e histologia. O objetivo deste artigo é discutir o uso da ultrassonografia no estadiamento axilar, com ênfase nas principais alterações morfológicas dos linfonodos metastáticos neste exame. MÉTODO O método adotado foi a pesquisa bibliográfica sistematizada para a produção de um artigo de revisão, de modo a responder ao objetivo proposto. Foi utilizada a busca ativa de artigos contendo o tema proposto, por meio de browser científico (Google Scholar), portais (Faculdade de Medicina da Universidade de São Paulo e Conselho Federal de Medicina), bancos de dados bibliográficos virtuais (Medline, Lilacs, Cochrane, SciELO, High Wire, Ovid), utilizando como palavras-chave: linfonodos axilares, ultrassonografia, aspectos morfológicos. A busca foi realizada no período de janeiro a agosto de 2012. Foram utilizadas, neste artigo, 22 referências, as quais contemplavam melhor o tema proposto. REVISÃO A ultrassonografia é amplamente disponível e, quando combinada a PAAF ou core biópsia, torna-se o método mais significativo na avaliação pré-operatória de linfonodos axilares(10). Frente a um resultado citológico ou histológico negativo para metástase axilar, aumentamos o valor preditivo negativo da BLS; por outro lado, se o resultado for positivo, reduzimos o tempo cirúrgico, dispensando a biópsia. Outro benefício deste método seria reduzir a incidência de mapeamento linfático inadequado ao se identificar previamente, pela ultrassonografia, linfonodos com depósitos tumorais, os quais aumentam a pressão linfática, reduzindo a captação do coloide radioativo(11). O linfonodo sentinela positivo, como citado anteriormente, em muitos casos é o único acometido, não sendo sua biópsia um modo adequado de avaliar a extensão do envolvimento axilar(2,6). Já o uso da ultrassonografia associada a PAAF, no estudo de Moore et al. demonstrou alta probabilidade de acometimento axilar extenso (mais de quatro linfonodos) quando presentes alterações morfológicas como ausência de hilo e/ou extensão extracapsular e confirmação citológica de malignidade(12). Apesar de apresentar, em muitos estudos, elevada acurácia, os critérios diagnósticos de malignidade e a indicação do exame ainda são controversos(4). CARACTERÍSTICAS MORFOLÓGICAS Comumente, um linfonodo benigno apresenta-se ovalado, com córtex hipoecogênico, extremamente fino ou até invisível à ultrassonografia, e com hilo hiperecogênico por conter trabéculas de tecido conjuntivo, cordões de tecido linfático e sinusoides medulares. Alterações como espessamento do córtex, diminuição ou ausência do hilo, mudanças no formato ou no padrão vascular são consideradas suspeitas. Atualmente, muitos estudos usam como critérios de definição de risco de metástase o espessamento cortical e a ausência de hilo(11,12–16). A ausência do hilo, tornando o linfonodo completamente hipoecogênico, é a alteração mais específica para doença metastática(13,16), porém, este achado apresenta-se apenas em casos avançados. O grande desafio no diagnóstico ultrassonográfico está na avaliação de linfonodos nos quais se observam córtex e hilo em variadas formas, correspondendo a estádios iniciais de doença metastática, casos estes responsáveis pela maior proporção de falso-negativos(11–13,16). Células metastáticas na linfa chegam ao linfonodo por vasos linfáticos aferentes na face convexa do órgão. A linfa é então filtrada, passando através do córtex, paracórtex e, finalmente, hilo(17). Depósitos metastáticos são represados na periferia do linfonodo, causando alargamento do córtex, habitualmente focal, quando em um estágio inicial, ou uniforme. Acometimento mínimo do linfonodo, com depósitos entre 0,2 mm e 2 mm (micrometástases) e menor que 0,2 mm (células tumorais isoladas) não se relacionam com alterações morfológicas significativas do linfonodo, limitando a utilidade da ultrassonografia nestes casos e sendo o diagnóstico feito por histologia e imuno-histoquímica. Com o objetivo de estimar a suspeição baseada na imagem, muitos autores elaboraram classificações envolvendo a espessura do córtex. Cho et al.(11), por exemplo, categorizaram as imagens em cinco graus: grau 1, linfonodos com córtex < 1,5 mm; grau 2, córtex > 1,5 e < 2,5 mm; grau 3, córtex > 2,5 mm e < 3,5 mm; grau 4, córtex > 3,5 mm e hilo intacto; grau 5, córtex > 3,5 mm e ausência de hilo. Concluíram que esta classificação é eficaz na pesquisa de metástase, sendo que a espessura do córtex acima de 2,5 mm indica estudo citológico ou histológico. Bedi et al.(13) formularam uma classificação semelhante, dividindo as imagens em seis tipos: tipo 1, sem córtex visível; tipo 2, córtex < 3 mm; tipo 3, córtex > 3 mm; tipo 4, córtex inteiramente lobulado; tipo 5, córtex com lobulação focal; tipo 6, linfonodo completamente hipoecogênico, sem hilo. Consideraram suspeitos e com indicação de biópsia os linfonodos tipos 5 e 6, as alterações reacionais foram frequentes no tipo 3, enquanto o tipo 4 foi denominado provavelmente benigno, pois englobou a maior parte dos resultados falso-negativos (Figuras 1 a 7). 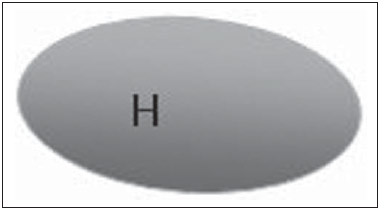 Figura 1. Linfonodo tipo 1 de Bedi. Sem córtex visível. (H, hilo). 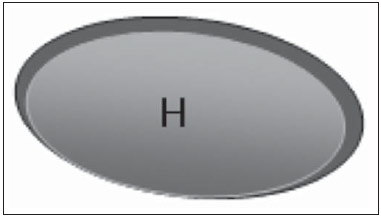 Figura 2. Linfonodo tipo 2 de Bedi. Córtex uniforme e menor ou igual a 3 mm. (H, hilo). 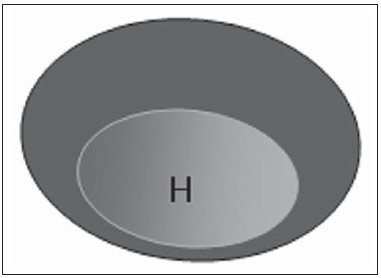 Figura 3. Linfonodo tipo 3 de Bedi. Córtex uniforme e maior que 3 mm. (H, hilo). 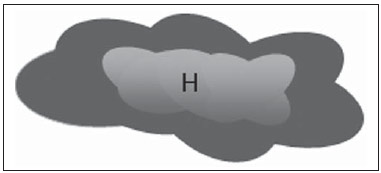 Figura 4. Linfonodo tipo 4 de Bedi. Córtex inteiramente lobulado. (H, hilo). 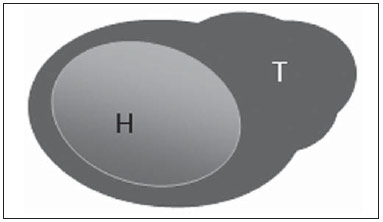 Figura 5. Linfonodo tipo 5 de Bedi. Córtex com lobulação focal. (H, hilo; T, depósito tumoral).  Figura 6. Linfonodo tipo 6 de Bedi. Linfonodo completamente hipoecogênico, hilo ausente. (T, depósito tumoral). 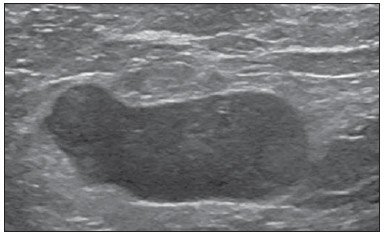 Figura 7. Linfonodo tipo 6 de Bedi, imagem ultrassonográfica. Linfonodo sem hilo aparente. Mainiero et al(14). usaram 3 mm como ponto de corte para espessura cortical, além da presença ou não de lobulação e ausência de hilo. Já Deurloo et al.(18) usaram medida acima de 2,3 mm como fator preditor de metástase. Nota-se que a espessura cortical usada como ponto de corte para predição de doença metastática varia bastante na literatura, assim como a sensibilidade e a especificidade do exame em função do valor escolhido. Diante deste fato, alguns autores optam por utilizar relação córtex/hilo, em vez do valor absoluto do córtex; neste caso, o espessamento cortical está presente quando a máxima espessura do córtex é igual ou maior que a espessura do hilo gorduroso(16,19) (Figuras 8 a 10). 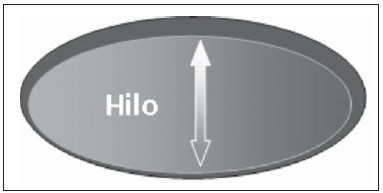 Figura 8. Representação de espessura normal do córtex. Medida do hilo gorduroso maior que a espessura do córtex. 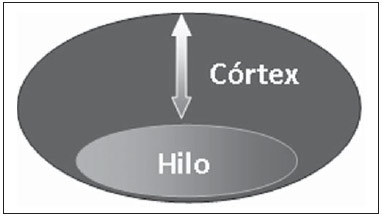 Figura 9. Representação de espessamento cortical. Espessura do córtex maior ou igual à espessura do hilo gorduroso. 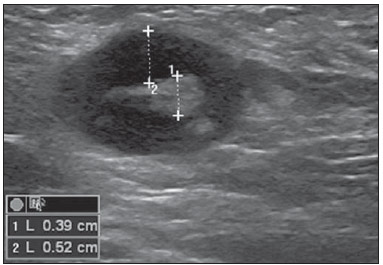 Figura 10. Linfonodo com espessamento cortical na ultrassonografia. Máxima espessura do córtex (2) maior que a espessura do hilo (1). Quanto a outras características morfológicas, a alteração do formato do linfonodo geralmente ocorre em casos avançados, associada à ausência do hilo. O tamanho já foi considerado um critério importante, porém estudos recentes não demonstraram relação significativa entre tamanho e malignidade(13,20). Moore et al.(12) observaram que a combinação de linfonodos alterados e normais em um mesmo exame seria um critério importante. Em seu estudo, linfonodos com espessamento cortical não associados a linfonodos normais corresponderam aos casos falso-positivos. A vascularização estudada ao Doppler segue basicamente dois padrões, o central, com sinal vascular único hilar ou sinais dispersos distribuídos no centro do órgão, e o periférico, no qual se observa sinal linear seguindo a periferia do linfonodo. A vascularização periférica é mais frequente em linfonodos metastáticos, enquanto o padrão central é mais encontrado na ausência de malignidade. Os índices de resistência, pulsatilidade e velocidade no pico sistólico não diferem em linfonodos malignos ou benignos quando os linfonodos são axilares, entretanto, a relevância destes dados já foi comprovada em estudos de linfonodos cervicais(15). A importância do uso do Doppler como critério diagnóstico se dá quando associado a outras características morfológicas e não como critério isolado(15,16). INDICAÇÃO DO EXAME E ESCOLHA DO PROCEDIMENTO (PAAF × CORE BIÓPSIA) O uso indiscriminado da ultrassonografia seguida de PAAF ou core biópsia já se mostrou pouco prático e dispendioso(12,18). Quanto maior o tumor primário da mama, maior a chance de metástase axilar, sendo assim clara a indicação do procedimento nestes casos. Entretanto, a indicação em casos de tumores primários menores que 2 cm (T1) ainda não está estabelecida. Mainiero et al.(14) reduziram as biópsias de linfonodo sentinela em 6% ao indicar ultrassonografia e PAAF para pacientes com tumores menores que 1 cm. Este número subiu para 17% nos casos de tumores primários entre 1 e 2 cm e para 42% entre 2 cm e 5 cm. Uma vez encontrado um linfonodo anormal, a questão recai sobre qual procedimento seria o mais adequado: PAAF ou core biópsia. Esta decisão deve ser feita levando-se em conta vários aspectos particulares de cada um. A PAAF é rápida, apresenta elevadas sensibilidade e especificidade, além de ser menos invasiva; por outro lado, exige citologista experiente, profissional disponível em poucas instituições. A core biópsia, embora de custo mais elevado, proporciona material para imuno-histoquímica, não é patologistadependente e tem sensibilidade maior em relação à PAAF(21). Entretanto, um resultado negativo não exclui a BLS, uma vez que a core biópsia, assim como a PAAF, apresenta uma porcentagem de falso-negativos em função de pequenos depósitos metastáticos(16). É importante ressaltar que a core biópsia, embora tenha maior potencial de complicações, como sangramento e lesão nervosa, mostrou-se bastante segura em uma técnica descrita por Abe et al., na qual a cânula só atravessa o tecido já delimitado pela agulha(22). CONCLUSÃO A ultrassonografia é uma importante arma na avaliação pré-operatória de linfonodos axilares de pacientes portadoras de câncer de mama. Seu uso possibilita a identificação da extensão da doença axilar e auxílio na biópsia percutânea, porém apresenta benefício limitado em casos de mínimo comprometimento linfonodal, como micrometástases e células tumorais isoladas. Alterações como espessamento cortical e ausência de hilo são preditoras de doença metastática, estando indicada avaliação citológica ou histológica quando presentes. A ultrassonografia axilar e punção/biópsia eletiva devem fazer parte da rotina diagnóstica do câncer de mama, especialmente em casos de tumor primário acima de 1 cm, que mais se beneficiam do método. A escolha entre PAAF e core biópsia deve ser feita de acordo com o equipamento e profissionais disponíveis na instituição. REFERÊNCIAS 1. Krag DN, Weaver DL, Alex JC, et al. Surgical resection and radio-localization of the sentinel lymph node in breast cancer using a gamma probe. Surg Oncol. 1993;2:335–9. 2. Giuliano AE, Han SH. Local and regional control in breast cancer: role of sentinel node biopsy. Adv Surg. 2011;45:101–16. 3. Kell MR, Burke JP, Barry M, et al. Outcome of axillary staging in early breast cancer: a meta-analysis. Breast Cancer Res Treat. 2010;120:441–7. 4. Reynolds C, Mick R, Donohue JH, et al. Sentinel lymph node biopsy with metastasis: can axillary dissection be avoided in some patients with breast cancer? J Clin Oncol. 1999;17:1720–6. 5. Pazaiti A, Fentiman IS. Which patients need an axillary clearance after sentinel node biopsy? Int J Breast Cancer. 2011;2011:195892. 6. Giuliano AE, McCall L, Beitsch P, et al. Locoregional recurrence after sentinel lymph node dissection with or without axillary dissection in patients with sentinel lymph node metastases: the American College of Surgeons Oncology Group Z0011 randomized trial. Ann Surg. 2010;252:426–32. 7. Pamilo M, Soiva M, Lavast EM. Real-time ultrasound, axillary mammography, and clinical examination in the detection of axillary lymph node metastases in breast cancer patients. J Ultrasound Med. 1989;8:115–20. 8. Rahbar H, Partridge SC, Javid SH, et al. Imaging axillary lymph nodes in patients with newly diagnosed breast cancer. Curr Probl Diagn Radiol. 2012;41:149–58. 9. Gentilini O, Veronesi U. Abandoning sentinel lymph node in early breast cancer? A new trial in progress at the European Institute of Oncology of Milan (SOUND: Sentinel node vs Observation after axillary UltraSouND). Breast. 2012;21:678–81. 10. Alvarez S, Añorbe E, Alcorta P, et al. Role of sonography in the diagnosis of axillary lymph node metastases in breast cancer: a systematic review. AJR Am J Roentgenol. 2006;186:1342–8. 11. Cho N, Moon WK, Han W, et al. Preoperative sonographic classification of axillary lymph nodes in patients with breast cancer: node-to-node correlation with surgical histology and sentinel node biopsy results. AJR Am J Roentgenol. 2009;193:1731–7. 12. Moore A, Hester M, Nam MW, et al. Distinct lymph nodal sonographic characteristics in breast cancer patients at high risk for axillary metastases correlate with the final axillary stage. Br J Radiol. 2008;81:630–6. 13. Bedi DG, Krishnamurthy R, Krishnamurthy S, et al. Cortical morphologic features of axillary lymph nodes as a predictor of metastasis in breast cancer: in vitro sonographic study. AJR Am J Roentgenol. 2008;191:646–52. 14. Mainiero MB, Cinelli CM, Koelliker SL, et al. Axillary ultrasound and fine-needle aspiration in the preoperative evaluation of the breast cancer patient: an algorithm based on tumor size and lymph node appearance. AJR Am J Roentgenol. 2010;195:1261–7. 15. Yang WT, Chang J, Metreweli C. Patients with breast cancer: differences in color Doppler flow and gray-scale US features of benign and malignant axillary lymph nodes. Radiology. 2000;215:568–73. 16. Abe H, Schmidt RA, Kulkarni K, et al. Axillary lymph nodes suspicious for breast cancer metastasis: sampling with US-guided 14-gauge core-needle biopsy – clinical experience in 100 patients. Radiology. 2009;250:41–9. 17. van der Valk P, Meijer CJL. Reactive lymph nodes. In: Sternberg SS, ed. Histology for pathologists. 2nd ed. Philadelphia, PA: Lippincott Raven; 1997. p. 651–73. 18. Deurloo EE, Tanis PJ, Gilhuijs KG, et al. Reduction in the number of sentinel lymph node procedures by preoperative ultrasonography of the axilla in breast cancer. Eur J Cancer. 2003;39:1068–73. 19. Luparia A, Campanino P, Cotti R, et al. Role of axillary ultrasound in the preoperative diagnosis of lymph node metastases in patients affected by breast carcinoma. Radiol Med. 2010;115:225–37. 20. Koelliker SL, Chung MA, Mainiero MB, et al. Axillary lymph nodes: US-guided fine-needle aspiration for initial staging of breast cancer – correlation with primary tumor size. Radiology. 2008;246:81–9. 21. Rao R, Lilley L, Andrews V, et al. Axillary staging by percutaneous biopsy: sensitivity of fine-needle aspiration versus core needle biopsy. Ann Surg Oncol. 2009;16:1170–5. 22. Abe H, Schmidt RA, Sennett CA, et al. US-guided core needle biopsy of axillary lymph nodes in patients with breast cancer: why and how to do it. Radiographics. 2007;27 Suppl 1:S91–9. 1. Especialista, Médica Mastologista do Hospital do Servidor Público Estadual "Francisco Morato de Oliveira" (HSPE), São Paulo, SP, Brasil 2. Doutora, Mastologista da Escola Paulista de Medicina da Universidade Federal de São Paulo (EPM-Unifesp), São Paulo, SP, Brasil 3. Livre-docente, Chefe do Departamento de Ginecologia e da Disciplina de Mastologia da Escola Paulista de Medicina da Universidade Federal de São Paulo (EPM-Unifesp), São Paulo, SP, Brasil Endereço para correspondência: Dra. Simone Elias Avenida Ibirapuera, 2907, sala 218, Indianópolis São Paulo, SP, Brasil, 04029-200 E-mail: simone.elias@me.com Recebido para publicação em 4/2/2013. Aceito, após revisão, em 17/10/2013. Trabalho realizado na Escola Paulista de Medicina da Universidade Federal de São Paulo (EPM-Unifesp), São Paulo, SP, Brasil. |
|
Av. Paulista, 37 - 7° andar - Conj. 71 - CEP 01311-902 - São Paulo - SP - Brazil - Phone: (11) 3372-4544 - Fax: (11) 3372-4554