Radiologia Brasileira - Publicação Científica Oficial do Colégio Brasileiro de Radiologia
AMB - Associação Médica Brasileira CNA - Comissão Nacional de Acreditação
 Vol. 51 nº 2 - Mar. / Abr. of 2018
Vol. 51 nº 2 - Mar. / Abr. of 2018
|
ARTIGO ORIGINAL
|
|
|
|
|
Autho(rs): Antonio Rahal Junior1; Priscila Mina Falsarella1; Vinicius Tadeu Rodrigues Ferreira2; Guilherme Cayres Mariotti1; Marcos Roberto Gomes de Queiroz1; Rodrigo Gobbo Garcia1 |
|
|
Descritores: Técnicas hemostáticas; Hemostáticos/administração & dosagem; Biópsia por agulha/métodos; Hemorragia/prevenção & controle. |
|
|
Resumo: INTRODUÇÃO
Biópsias percutâneas são procedimentos seguros e pouco invasivos, quando comparados com as técnicas cirúrgicas convencionais, e são utilizados para diagnóstico histológico de lesões em órgãos sólidos(1). A despeito de se tratar de método seguro, algumas vezes tais procedimentos podem cursar com sangramento de difícil controle, sobretudo em pacientes com distúrbio de coagulação(2). Todavia, a não realização do procedimento pode retardar o início do tratamento apropriado. O risco de sangramento de uma biópsia depende de vários fatores, que devem ser minuciosamente avaliados antes do procedimento(2). Distúrbio de coagulação é o fator que mais contribui no aumento do risco de sangramento(3), e os pacientes com quantidade de plaquetas sérica inferior a 50.000/mm3 e/ou razão normalizada internacional superior a 1,5 são os que apresentam risco aumentado para sangramento. Em oposição, há fatores que contribuem para a redução de sangramento, como a transfusão de hemoderivados, de acordo com a indicação e a suspensão de antiagregantes plaquetários ou anticoagulantes quando possível. No campo dos fatores técnicos, o planejamento do melhor acesso para atingir a lesão, com escolha do melhor método de imagem para orientação – seja ultrassonografia, tomografia, fusão de imagens de ultrassonografia com outras técnicas, tais como ressonância, tomografia e tomografia por emissão de pósitrons –, colabora para redução de risco de sangramento e maior precisão da técnica. O uso de agulha coaxial como guia para a agulha de corte também é elemento importante que reduz o risco de sangramento, uma vez que evita a repetição de trauma perfurocortante no trajeto da biópsia(4), além do uso da agulha de corte semiautomática, pela possibilidade de maior controle na progressão da sua extremidade. Uma forma complementar de agregar segurança ao procedimento, reduzindo o risco de sangramento, é a realização da embolização do trajeto da agulha com matrizes hemostáticas, agentes já utilizados há algumas décadas em cirurgias abertas(5), mas de aplicação relativamente recente em procedimentos percutâneos guiados por imagem. Atualmente, várias matrizes hemostáticas são disponíveis para utilização, por exemplo, de gelatina, colágeno, celulose, e outras. Entre elas, a matriz de gelatina absorvível é a mais comumente utilizada(2). Visto que muitos dos pacientes que necessitam de biópsia são portadores de doenças com tendências hemorrágicas(6), como os hepatopatas e nefropatas(7), e considerando o risco aumentado para sangramento de grande parte das lesões focais, decorrente de sua hipervascularização, o conhecimento e a aplicação desta técnica, para casos selecionados, vem sendo de grande valia na prática médica, com especial enfoque na intervenção. O objetivo deste estudo é descrever a técnica de injeção de matrizes hemostáticas, assim como a experiência do nosso serviço na sua aplicação, as complicações associadas e seu manejo pelo radiologista intervencionista. MATERIAIS E MÉTODOS Este é um estudo unicêntrico, com análise retrospectiva da experiência do nosso grupo na utilização de matriz hemostática gelatinosa à base de pele suína purificada (Gelfoam®; Pfizer, New York, NY, EUA) em biópsias percutâneas, realizado no centro de medicina intervencionista da nossa instituição. Pacientes No período de outubro de 2013 a maio de 2016, 73 pacientes (39 homens e 34 mulheres) com idade entre 12 e 84 anos (média: 54,1 anos; mediana: 54 anos) foram encaminhados ao setor de radiologia intervencionista do nosso hospital e submetidos a biópsia percutânea guiada por imagem com injeção de Gelfoam no trajeto da biópsia. Os critérios de inclusão foram pacientes com risco aumentado de sangramento por trombocitopenia ou coagulopatia (contagem de plaquetas inferior a 75.000/mm3 e/ou razão normalizada internacional superior a 1.5), ou pacientes nos quais, por terem comorbidades associadas, o risco de sangramento não seria aceitável. Os critérios de exclusão foram pacientes com contraindicação ao uso de Gelfoam por alergia conhecida a colágeno porcino. Todos os pacientes assinaram termo de consentimento informado antes da realização da biópsia. Procedimento Todas as biópsias foram realizadas com técnica asséptica, após planejamento do melhor trajeto, evitando-se estruturas nobres ou vasos, e guiadas por tomografia computadorizada (Somatom Definition AS 40-slice – Siemens, Berlim, Alemanha) ou por ultrassonografia com ou sem fusão de imagens (IU 22 Philips – Philips Healthcare, Andover, MA, EUA; Aplio 500 Platinum – Toshiba American Medical Systems, Tustin, CA, EUA; Logiq E9 VNav – General Electric Healthcare, Milwaukee, WI, EUA). Cada biópsia foi realizada por um entre dez experientes radiologistas intervencionistas (experiência de mais de cinco anos). A anestesia utilizada (anestésico local com ou sem sedação, ou anestesia geral associado a infiltração com anestésico local) variou de acordo com as características do local a ser biopsiado, posicionamento necessário e as características do paciente. Os procedimentos foram realizados necessariamente com agulha coaxial 16, 17 ou 19 gauge, a depender da estrutura alvo, em associação com agulha de corte semiautomática 18 ou 20 gauge. Técnica Finalizada a biópsia, Gelfoam cortado em pequenos pedaços de aproximadamente 2 a 3 mm ou em pó era misturado em soro fisiológico, utilizando-se duas seringas de 10 mL acopladas por uma torneira de três vias até a formação de uma pasta (Figura 1). O volume administrado foi cerca de 2 a 4 mL da pasta em cada caso, por meio de agulha coaxial, no trajeto da biópsia, iniciando-se no local alvo da biópsia até a cápsula do órgão, guiado por imagem. 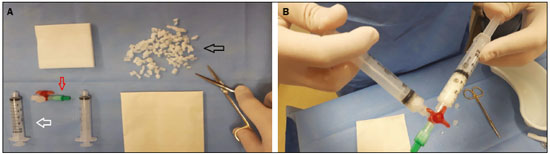 Figura 1. A: Gelfoam cortado em pequenos pedaços (seta preta), seringas (seta branca) e torneira de três vias (seta vermelha) para preparação da pasta de matriz hemostática. B: Diluição do Gelfoam com soro fisiológico. Após a realização da biópsia, os pacientes permaneceram em observação na recuperação pós-anestésica. Na primeira hora foram submetidos a ultrassonografia e permaneceram em observação por um período de 4 a 8 horas, a depender do sítio primário da biópsia (biópsia de rim primitivo randômica ou nódulo, 8 horas; demais estruturas, 4 horas), com monitoração de sinais vitais (pressão arterial e frequência cardíaca), além de avaliação de escore de dor e demais sintomas. Transcorrido esse período, os pacientes eram liberados para casa ou para a unidade de internação (no caso dos pacientes previamente internados). RESULTADOS Foram realizadas 73 biópsias com utilização de pasta de Gelfoam no trajeto da agulha coaxial, sendo 55 biópsias hepáticas (50 lesões focais e 5 biópsias randômicas em pacientes pós-transplante hepático), 13 renais (8 casos de biópsias de rim primitivo randômicas, 4 lesões focais e 1 caso de biópsia de rim transplantado randômica), 1 caso de tumor escapular, 1 de linfonodo peri-hepático, 1 de massa abdominal, 1 de baço e 1 caso de lesão de mandíbula. A única complicação observada foi a migração da matriz hemostática para o sistema coletor esquerdo, em um caso de biópsia de lesão renal central, causando obstrução do ureter distal, na junção ureterovesical, e dilatação do sistema coletor a montante. Tal complicação foi solucionada por meio de sondagem vesical de demora com três vias e irrigação contínua com soro fisiológico (Figura 2). Não foram observados casos de sangramento no trajeto das biópsias após a injeção de matrizes hemostáticas com necessidade de hemotransfusão ou outras terapias. 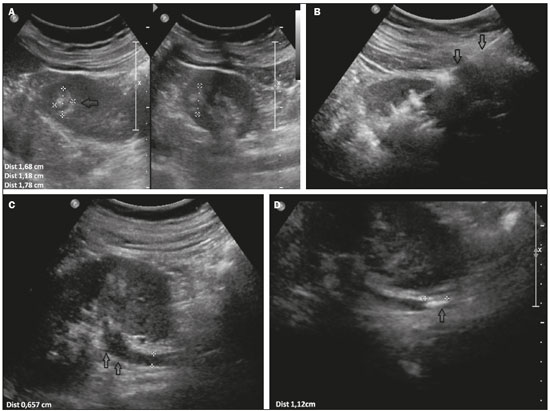 Figura 2. A: Ultrassonografia renal com nódulo (seta) localizado no terço médio do rim esquerdo. B: Injeção de matriz hemostática por agulha coaxial (setas) após o término da biópsia. C: Dilatação ureteral (setas). D: Presença de estrutura hiperecoica (seta) localizada no ureter, associado a dilatação proximal. DISCUSSÃO Entre as complicações pós-biópsia de órgãos sólidos, o sangramento é a mais frequente e uma das mais temidas(1). O uso de matrizes hemostáticas tem se mostrado importante aliado nesses procedimentos minimamente invasivos, especialmente em pacientes com coagulopatia ou com lesões focais hipervasculares. Sua aplicação tem se mostrado efetiva em biópsias de vários órgãos, como rim, fígado, massas sólidas e demais órgãos parenquimatosos. O Gelfoam apresenta, como vantagens, ser absorvível em dias a semanas, dependendo da quantidade utilizada, ter adaptação fácil ao local aplicado e absorver até 40 vezes seu peso em sangue ou fluidos(2). Os benefícios observados da injeção de Gelfoam no trajeto de biópsias em pacientes com distúrbios de coagulação incluem, sobretudo, a redução do risco de sangramento, pelo tamponamento exercido pela expansão da matriz no local aplicado, formando um coágulo artificial e facilitando a coagulação no local em que a matriz artificial foi utilizada(8). Entretanto, entre os riscos existe a possibilidade de migração, decorrente a baixa adesão tecidual, formação de granuloma ou abscesso local, sintomas compressivos devidos à expansão da matriz, alergias(9–11). As desvantagens associadas são decorrentes da baixa adesividade da solução, e em áreas com hemorragia ativa a suspensão pode ser eliminada na corrente sanguínea(2). Paulson et al.(12), em estudo de biópsias hepáticas percutâneas realizado em cães, demonstraram redução imediata na taxa de sangramento quando se utilizou matriz hemostática no trajeto da biópsia em comparação com grupo controle, e também nos casos em vigência de anticoagulação com e sem a utilização de matriz hemostática. É importante mencionar que, apesar das vantagens dessa técnica, entendemos que sua aplicação encontra justificativa em pacientes com alto risco de sangramento, seja em razão do tipo de lesão abordada, seja em função de distúrbios de coagulação apresentados pelo paciente, como os renais crônicos, os transplantados hepáticos e os idosos, por suas múltiplas potenciais comorbidades associadas. Os dados observados na nossa série estão em concordância com algumas séries disponíveis na literatura(6,13). As limitações deste estudo foram seu desenho retrospectivo sem grupo de controle para comparação, assim como a variabilidade de locais de aplicação e de calibres de agulhas utilizadas. CONCLUSÃO O uso de matrizes hemostáticas no trajeto de biópsias percutâneas é mais uma ferramenta disponível e de fácil utilização a ser considerada nos procedimentos minimamente invasivos, que pode reduzir o risco de sangramento, principalmente nos pacientes mais críticos. REFERÊNCIAS 1. Smith EH. Complications of percutaneous abdominal fine-needle biopsy. Review. Radiology. 1991;178:253–8. 2. Tsang WK, Luk WH, Lo A. Ultrasound-guided plugged percutaneous biopsy of solid organs in patients with bleeding tendencies. Hong Kong Med J. 2014;20:107–12. 3. Eiro M, Katoh T, Watanabe T. Risk factors for bleeding complications in percutaneous renal biopsy. Clin Exp Nephrol. 2005;9:40–5. 4. Hopper KD, Grenko RT, TenHave TR, et al. Percutaneous biopsy of the liver and kidney by using coaxial technique: adequacy of the specimen obtained with three different needles in vitro. AJR Am J Roentgenol. 1995;164:221–4. 5. Carvalho MV, Marchi E, Pantoroto M, et al. Topical haemostatic agents and tissue adhesives. Rev Col Bras Cir. 2013;40:66–71. 6. Wong P, Johnson KJ, Warner RL, et al. Performance of biopsy needle with therapeutic injection system to prevent bleeding complications. J Med Device. 2013;7:110021–7. 7. Korbet SM. Percutaneous renal biopsy. Semin Nephrol. 2002;22: 254–67. 8. Guralnick WC, Berg L. Gelfoam in oral surgery; a report of 250 cases. Oral Surg Oral Med Oral Pathol. 1948;1:632–9. 9. Lindstrom PA. Complications from the use of absorbable hemostatic sponges. AMA Arch Surg. 1956;73:133–41. 10. Knowlson GT. Gel-foam granuloma in the brain. J Neurol Neurosurg Psychiatry. 1974;37:971–3. 11. Schonauer C, Tessitore E, Barbagallo G, et al. The use of local agents: bone wax, gelatin, collagen, oxidized cellulose. Eur Spine J. 2004;13 Suppl 1:S89–96. 12. Paulson EK, Stephenson GR, Neal MC, et al. Use of fibrin sealant as a hemostatic agent after liver biopsy in swine. J Vasc Interv Radiol. 2000;11:905–11. 13. Kallmes DF, McGraw JK, Li ST, et l. In vivo evaluation of a new type I collagen hemostatic plug for high-risk, large-core biopsies. J Vasc Interv Radiol. 1998;9:656–9. 1. Médicos do Departamento de Radiologia Intervencionista do Hospital Israelita Albert Einstein, São Paulo, SP, Brasil 2. Pesquisador do Departamento de Radiologia Intervencionista do Hospital Israelita Albert Einstein, São Paulo, SP, Brasil Trabalho realizado no Departamento de Radiologia Intervencionista do Hospital Israelita Albert Einstein, São Paulo, SP, Brasil. Endereço para correspondência: Dra. Priscila Mina Falsarella Departamento de Radiologia Intervencionista, Hospital Israelita Albert Einstein Avenida Albert Einstein, 627, Morumbi São Paulo, SP, Brasil, 05652-900 E-mail: primina@gmail.com Recebido para publicação em 20/1/2017. Aceito, após revisão, em 20/3/2017. |
|
Av. Paulista, 37 - 7° andar - Conj. 71 - CEP 01311-902 - São Paulo - SP - Brazil - Phone: (11) 3372-4544 - Fax: (11) 3372-4554