Radiologia Brasileira - Publicação Científica Oficial do Colégio Brasileiro de Radiologia
AMB - Associação Médica Brasileira CNA - Comissão Nacional de Acreditação
 Vol. 53 nº 5 - Set. / Out. of 2020
Vol. 53 nº 5 - Set. / Out. of 2020
|
ARTIGO DE REVISÃO
|
|
|
|
|
Autho(rs): Thais Coura Figueiredo Agostini1,a; Reginaldo Figueiredo2,b; Gisele Warmbrand3,c; Ulysses Santos Torres3,4,d; Hanna Rafaela Ferreira Dalla Pria1,e; Giuseppe D’Ippolito1,f |
|
|
Descritores: Placenta acreta; Placenta prévia; Ressonância magnética. |
|
|
Resumo: INTRODUÇÃO
A desordem de adesão placentária (DAP), comumente denominada de acretismo placentário em nosso meio, é um distúrbio decorrente da alteração da decídua basal, levando à invasão de vilosidades coriônicas no miométrio(1), e a sua classificação baseia-se na profundidade da invasão uterina pelo tecido trofoblástico(2,3). A placenta acreta vera é a apresentação menos invasiva da DAP, caracterizada por fixação anormal da placenta diretamente no miométrio; já a placenta increta representa a invasão parcial da placenta no miométrio, e a placenta percreta se manifesta como invasão completa da placenta até ou além da serosa uterina, com ou sem extensão para os órgãos adjacentes(3,4). Os fatores de risco mais importantes para placenta acreta são cesariana prévia e placenta prévia, além de miomectomia conservadora, embolização da artéria uterina, curetagem, ruptura uterina prévia(1) e idade materna avançada(5). Pesquisas registram que a incidência de acretismo placentário é de 0,9% na população geral, havendo um aumento para 9% em caso de placenta prévia concomitante, que pode atingir até 35% quando ocorre associação de placenta prévia e cesariana pregressa(6). Em pacientes com múltiplas cesarianas (acima de três), o risco de placenta invasiva se torna muito elevado (67%)(5). O diagnóstico pré-natal de DAP é de extrema importância, pois esta se encontra frequentemente associada a hemorragia maciça pós-parto, histerectomia de emergência e morbimortalidade materna(1,5). A ultrassonografia (US) combinada com a técnica de Doppler colorido é a principal ferramenta diagnóstica para se avaliar a placenta anormal. No entanto, quando os achados ultrassonográficos são suspeitos ou inconclusivos, ou em casos de placentação posterior, a ressonância magnética (RM) é recomendada como técnica de imagem suplementar(7). A RM apresenta sensibilidade de 75–100% e especificidade de 65–100%, com valores preditivos negativo e positivo de 79–92% e 67–84,4%, respectivamente(1). Este método é útil para delinear a extensão placentária lateral ou posterior para os tecidos adiposos periuterinos ou paramétricos ou ainda para detectar invasão da bexiga(5). O objetivo do presente artigo é reunir os dez principais sinais observados na RM que possam contribuir para o diagnóstico de DAP. Além disso, criou-se um relatório estruturado abrangendo todos esses sinais e adotou-se um questionário que aborda os possíveis fatores de risco da paciente a ser submetida ao exame de RM da placenta. PROTOCOLO DE RM Os exames de RM podem ser realizados preferencialmente em aparelhos de 1,5-T, associados a bobina de superfície(4), visando a evitar os artefatos de suscetibilidade e o efeito dielétrico produzidos pelos equipamentos 3-T(8). A bexiga deve estar parcialmente repleta, para otimizar a avaliação da interface vesicouterina e evitar artefatos de movimento ou desconforto da paciente durante o exame com hiperdistensão vesical(2). O uso de oxigênio por meio de cânula nasal demonstrou diminuir o movimento fetal e oferece à gestante apneias mais prolongadas e confortáveis(9). As sequências de RM são realizadas nos planos axial, sagital e coronal, destacando-se: SSFSE/HASTE/SSHTSE T2, para avaliação das camadas uterinas e arquitetura placentária; FIESTA, TrueFISP, bFFE T2, visando a reduzir os artefatos de respiração, além de diferenciar as bandas hipointensas de lagos venosos; e sequências gradiente eco (GRE) ponderadas em T1, com a finalidade de identificar hematoma retroplacentário (Tabela 1)(6). Sequências com alta resolução temporal e boa relação contraste-ruído, que eliminam o movimento fetal subjacente, tornaram possíveis imagens placentárias de elevada qualidade diagnóstica(7). O exame deve ser monitorado pelo radiologista, para definir se sequências adicionais, como oblíquas coronais ou sagitais, são necessárias. 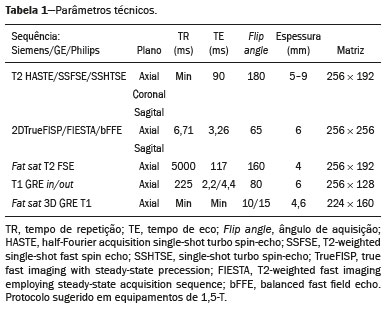 Os primeiros artigos abordando a utilização da RM no diagnóstico da DAP preconizavam o uso de meio de contraste intravenoso para otimizar a eficácia do método(10,11), porém, sem oferecer indícios robustos que justificassem a sua adoção. Em um estudo recentemente publicado com grande número de gestantes, os autores concluem que o uso de contraste paramagnético em qualquer fase da gestação aumentaria o risco de alterações reumatológicas e inflamatórias, bem como de óbito fetal e neonatal(12). Por essas razões, os exames de RM têm sido realizados sem o uso do meio de contraste intravenoso na pesquisa de DAP. Não existe consenso a respeito da idade gestacional ideal para se realizar o exame de RM em pacientes com suspeita de DAP. Evidências demonstram que o exame realizado antes da 24a semana apresenta acurácia muito baixa (< 50%), sendo considerada inaceitável(13). Por outro lado, a eficácia dos exames executados após a 35a semana de gestação diminui em decorrência do acentuado afilamento miometrial e heterogeneidade placentária natural, limitando a adoção desses dois sinais por RM. Parece sensato realizar o exame de RM idealmente entre a 30a e 35a semanas de gestação, quando possível, mas mesmo esta sugestão pode estar sujeita a críticas, pois há autores que recomendam o exame entre a 24a e 30a semanas de gestação, alegando que a placenta é naturalmente mais homogênea e o miométrio é menos afilado(7). DEZ SINAIS DE ACRETISMO PLACENTÁRIO NA RM Múltiplos sinais de RM têm sido descritos no espectro da DAP. Para tanto, podem ser divididos em alterações maiores e menores (Tabela 2), quando os achados apresentarem especificidade acima de 80% e abaixo de 80%, respectivamente. Os sinais incluem lobulação uterina anormal, protuberância placentária, heterogeneidade placentária, protrusão placentária no orifício cervical ou outras estruturas adjacentes, bandas intraplacentárias hipointensas em T2 associadas a retração placentária, banda de hipossinal em T2, indefinição da interface placentomiometrial, afilamento miometrial, vascularização placentária anormal e hipervascularização subserosa. 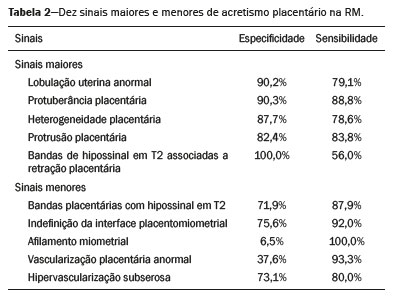 Sinais maiores Lobulação uterina anormal A lobulação uterina anormal pode aparecer como alargamento do segmento uterino inferior, assumindo uma aparência em forma de ampulheta, em lugar do habitual formato de pera invertida, nas imagens coronais e/ou sagitais(6,14) (Figura 1). 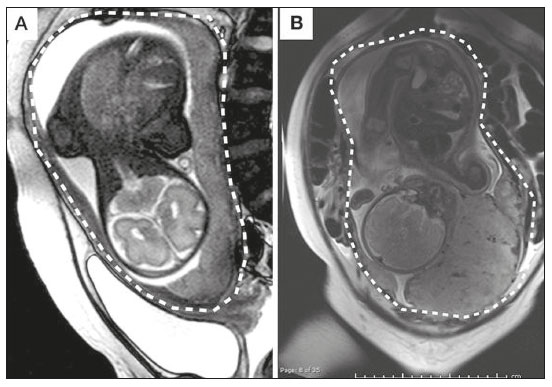 Figura 1. A: Imagem de RM na sequência sagital T2 demonstra o aspecto normal (em pera invertida) do útero gravídico, sem sinais de acretismo placentário. B: Imagem ponderada em T2 coronal mostra formato de ampulheta, sugerindo o diagnóstico de DAP. Protuberância placentária A protuberância placentária pode ser dividida em duas categorias, dependendo do contorno uterino. Quando ocorre discreta protuberância para fora do miométrio subjacente e o contorno está intacto e não distorcido, define- se como protuberância tipo I, e quando a placenta mostra protuberância focal, com contorno distorcido e alteração do contorno subjacente, é definida como protuberância tipo II(14) (Figura 2). 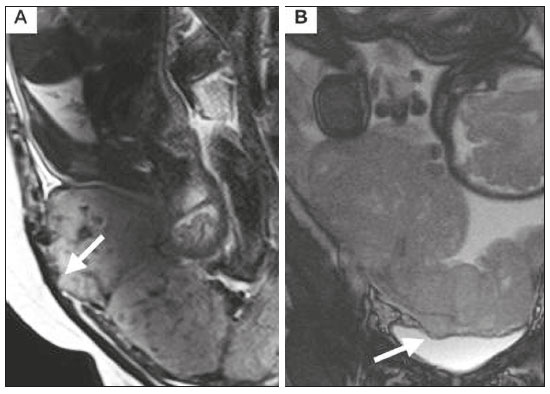 Figura 2. A,B: Imagens de RM na sequência sagital T2 demonstram protuberância placentária do tipo II (seta em A), com contorno uterino distorcido. Observa-se, ainda, abaulamento da parede vesical posterior devido a protuberância placentária (seta em B). Heterogeneidade placentária A placenta normal é lisa e homogênea e apresenta intensidade de sinal intermediário em T2(1). Com a progressão da gravidez, a placenta normalmente se torna heterogênea, habitualmente após a 32ª semana, conhecida como “heterogeneidade da maturidade placentária”(1). Em relação aos parâmetros de imagem, a heterogeneidade placentária permanece subjetiva e apresenta características como bandas e sinal de fluxo lentificado (flow-voids) intraplacentários, além de áreas de infarto placentário(14) (Figura 3). Até 30% das pacientes sem acretismo placentário podem apresentar este sinal. É importante observar que a homogeneidade placentária deve ser avaliada nas sequências SS-FSE/HASTE/SS-TSE T2, pois há uma tendência de subestimar a homogeneidade de sinal nas sequências FIESTA, TrueFISP, bFFE T2(11). 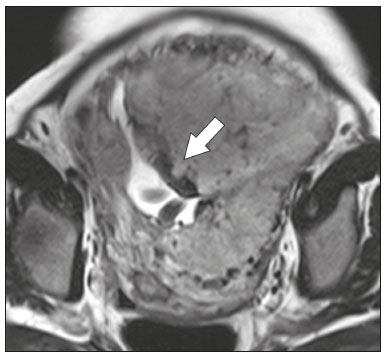 Figura 3. Imagem de RM na sequência sagital T2 mostrando heterogeneidade da placenta, caracterizada por alteração difusa de sinal associada a banda de hipossinal intraplacentária (seta). Protrusão placentária Este sinal consiste na invasão miometrial estendendo- se à serosa uterina ou através do orifício cervical interno e invadindo estruturas adjacentes(6). Nos casos de placenta prévia, a protrusão placentária no orifício cervical interno é um sinal confiável de placenta acreta (Figura 4). Nos casos de placenta percreta, a RM pode demonstrar extensão do tecido placentário além da serosa uterina, ou seja, para o paramétrio, bexiga ou intestino(14). Deve-se orientar a repleção parcial da bexiga, no momento da aquisição de imagens, com o objetivo de reduzir diagnósticos falso-positivos de invasão vesical(2). 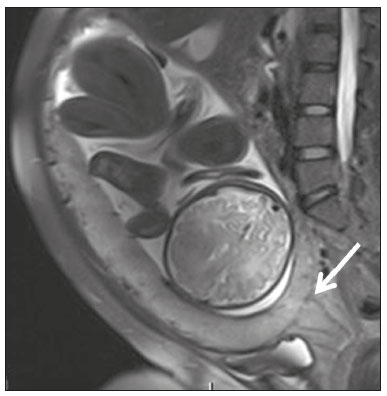 Figura 4. Imagem de RM ponderada em T2 na sequência sagital mostra protrusão placentária para o interior do orifício cervical interno. Bandas de hipossinal em T2 associadas a retração placentária A definição de retração placentária se traduz como sendo uma deformidade da placenta, com contração da superfície placentária e da borda externa do útero, com contorno em forma de cunha e espessura diminuída(15). É acompanhada por uma banda placentária com hipossinal em T2 (este é um sinal menor e será discutido posteriormente) (Figuras 5 e 6). 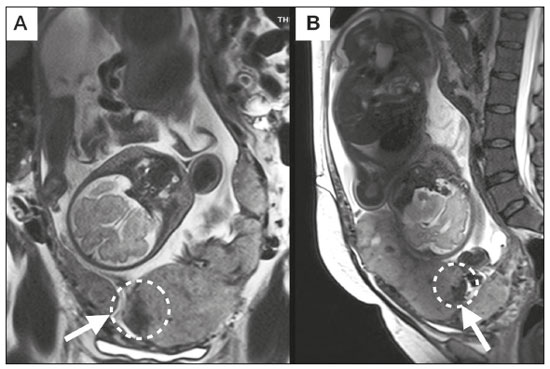 Figura 5. Imagens de RM ponderadas em T2 nas sequências coronal (A) e sagital (B) demonstram retração da superfície placentária (seta) e bandas com hipossinal (círculo pontilhado). 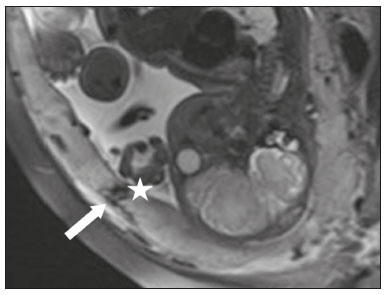 Figura 6. Imagem de RM ponderada em T2 na sequência sagital mostra retração da superfície placentária e bandas com hipossinal em T2 (estrela). Sinais menores Bandas placentárias com hipossinal em T2 As bandas placentárias são áreas nodulares ou lineares de baixa intensidade de sinal em imagens ponderadas em T2(2). Essas bandas frequentemente originam-se da placa basilar no lado materno da placenta e têm diâmetro longitudinal maior que 2,0 cm, espessura superior a 1,0 cm e distribuição aleatória(6). Essas características ajudam a diferenciá-las dos septos placentários normais, que tendem a ser finos e lisos(1). Acredita-se que representem áreas de deposição de fibrina na placenta, possivelmente decorrentes de hemorragia frequente e infarto. Existe relação entre o aumento do volume das bandas e os graus crescentes de invasão placentária(6). Caso a placenta apresente-se homogênea e sem bandas placentárias, é improvável que a paciente apresente placentação invasiva (Figuras 5 e 6). Indefinição da interface placentomiometrial A interface uteroplacentária consiste na linha demarcatória entre a placenta e o útero subjacente. O complexo no qual está inserida esta interface é composto por três camadas paralelas. A camada mais interna representa a decídua hipointensa em T2; a camada média representa o miométrio, com sinal intermediário; e a camada mais externa, com hipointensidade de sinal em T2, representa a serosa uterina(6). O adelgaçamento focal ou um defeito na interface uteroplacentária, particularmente a camada mais interna (Figura 7), é considerado preditor significativo de placenta invasora(6). Observa-se, ainda, que este sinal também pode ser inespecífico nos casos de idade gestacional avançada e afilamento no local da cesárea anterior. 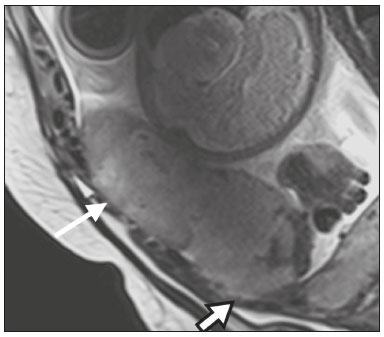 Figura 7. Imagem de RM ponderada em T2 na sequência sagital demonstra fina camada habitual com hipossinal entre o miométrio e a placenta (seta longa) e indefinição da interface placentomiometrial (seta curta). Afilamento miometrial O afilamento miometrial é definido como sendo a perda da aparência trilaminar do miométrio normal, com preservação da camada miometrial externa(14) (Figura 8). 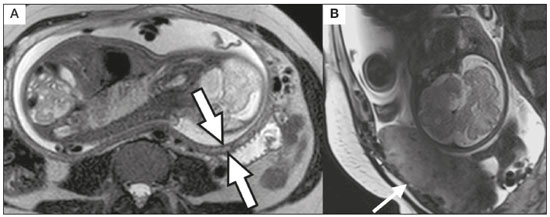 Figura 8. A: Imagem de RM ponderada em T2 axial mostra aspecto trilaminar normal do miométrio, representado pela camada hiperintensa média e as duas camadas externas e internas hipointensas (setas). B: Imagem em T2 sagital mostra afilamento miometrial apresentando indistinção das camadas (seta). Vascularização placentária anormal Este sinal está relacionado a vasos intraplacentários desorganizados, tortuosos e dilatados, com calibre maior que 0,6 cm, localizados geralmente junto a áreas de bandas intraplacentárias, com hipossinal em T2. Há provável relação entre a extensão dos vasos anormais e o grau de invasão, sendo a vascularização mais bizarra observada nos casos de placenta percreta(1). A identificação da vascularização anormal depende da comparação entre as sequências T2 HASTE/SSFSE/SSHTSE, em que os vasos apresentam ausência ou lentificação de fluxo (flow-voids), e as sequências FIESTA/TrueFISP/bFFE, nas quais os vasos apresentam hipersinal correspondente(6,14) (Figura 9). 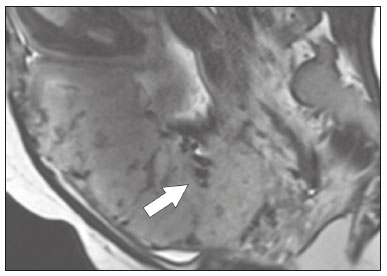 Figura 9. Imagem de RM ponderada em T2 na sequência sagital demonstra placenta prévia completa associada a vascularização placentária desorganizada, com vasos apresentando calibre de até 9 mm (seta). Hipervascularização subserosa A hipervascularização subserosa representa vasos tortuosos e compactados ao longo da serosa uterina, no segmento uterino inferior, nas imagens axiais, vistos como vasos com ausência/lentificação de fluxo (flow-voids)(14) (Figura 10). 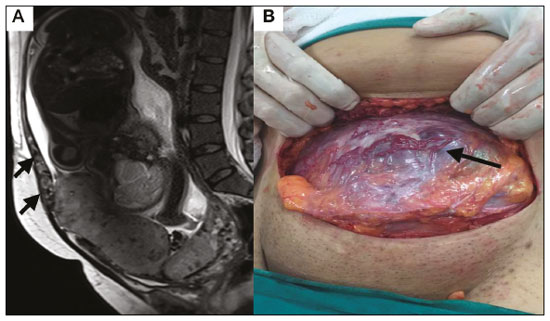 Figura 10. A: Imagem ponderada em T2 sagital representa a hipervascularização suberosa do útero, com flow voids (setas). B: Aspecto intraoperatório. RELATÓRIO ESTRUTURADO Os relatórios estruturados oferecem oportunidades para a melhoria na qualidade da informação pelos métodos de imagem. Ao se utilizar terminologia padronizada, promove-se maior clareza e objetividade na comunicação dos achados de imagem, que podem fornecer importantes benefícios no tratamento e acompanhamento da doença(16). Em nossa instituição foi elaborado um relatório estruturado abrangendo os principais sinais de DAP descritos na literatura, além dos parâmetros básicos de imagem (Figura 11). Foi também adotado um questionário que contempla os possíveis fatores de risco da paciente a ser submetida ao exame de RM de placenta (Tabela 3).  Figura 11. Modelo de relatório estruturado para RM de placenta com hipótese diagnóstica de acretismo placentário.  CONCLUSÃO O acretismo placentário tornou-se mais frequente, principalmente devido às taxas crescentes de cesarianas(7). A US permanece como a modalidade de imagem de primeira linha para avaliação placentária, no entanto, em casos de placenta posterior e achados duvidosos(6), a RM tem demonstrado acurácia satisfatória(8,17) e que justifica o seu uso para identificar a disseminação extrauterina da placenta, desempenhando papel importante no diagnóstico de placentação anormal em gestantes de alto risco(5). Lobulação uterina anormal, protuberância placentária, heterogeneidade placentária, protrusão placentária no orifício cervical ou outras estruturas adjacentes e bandas intraplacentárias hipointensas em T2, associadas a retração placentária, apresentam alta especificidade, sendo classificadas como sinais maiores. A adesão cuidadosa ao protocolo e a utilização do questionário direcionado e do relatório estruturado visam a incrementar a eficácia da RM e contribuem para o atendimento de pacientes com placentação invasiva, e assim apóiam o planejamento do tratamento multidisciplinar necessário para minimizar a morbimortalidade materna. REFERÊNCIAS 1. Cuthbert F, Vinas MT, Whitby E. The MRI features of placental adhesion disorder—a pictorial review. Br J Radiol. 2016;89:20160284. 2. Baughman WC, Corteville JE, Shah RR. Placenta accreta: spectrum of US and MR imaging findings. Radiographics. 2008;28:1905–16. 3. Bour L, Placé V, Bendavid S, et al. Suspected invasive placenta: evaluation with magnetic resonance imaging. Eur Radiol. 2014; 24:3150–60. 4. Derman AY, Nikac V, Haberman S, et al. MRI of placenta accreta: a new imaging perspective. AJR Am J Roentgenol. 2011;197:1514–21. 5. Bourgioti C, Zafeiropoulou K, Fotopoulos S, et al. MRI features predictive of invasive placenta with extrauterine spread in high-risk gravid patients: a prospective evaluation. AJR Am J Roentgenol. 2018;211:701–11. 6. Azour L, Besa C, Lewis S, et al. The gravid uterus: MR imaging and reporting of abnormal placentation. Abdom Radiol (NY). 2016; 41:2411–23. 7. Kilcoyne A, Shenoy-Bhangle AS, Roberts DJ, et al. MRI of placenta accreta, placenta increta, and placenta percreta: pearls and pitfalls. AJR Am J Roentgenol. 2017;208:214–21. 8. Rahaim NSA, Whitby EH. The MRI features of placental adhesion disorder and their diagnostic significance: systematic review. Clin Radiol. 2015;70:917–25. 9. Shetty MK, Dryden DK. Morbidly adherent placenta: ultrasound assessment and supplemental role of magnetic resonance imaging. Semin Ultrasound CT MR. 2015;36:324–31. 10. Levine D, Hulka CA, Ludmir J, et al. Placenta accreta: evaluation with color Doppler US, power Doppler US, and MR imaging. Radiology. 1997;205:773–6. 11. Lax A, Prince MR, Mennitt KW, et al. The value of specific MRI features in the evaluation of suspected placental invasion. Magn Reson Imaging. 2007;25:87–93. 12. Ray JG, Vermeulen MJ, Bharatha A, et al. Association between MRI exposure during pregnancy and fetal and childhood outcomes. JAMA. 2016;316:952–61. 13. Horowitz JM, Berggruen S, McCarthy RJ, et al. When timing is everything: are placental MRI examinations performed before 24 weeks’ gestational age reliable? AJR Am J Roentgenol. 2015;205:685–92. 14. Chen X, Shan R, Zhao L, et al. Invasive placenta previa: placental bulge with distorted uterine outline and uterine serosal hypervascularity at 1.5T MRI – useful features for differentiating placenta percreta from placenta accreta. Eur Radiol. 2018;28:708–17. 15. Sato T, Mori N, Hasegawa O, et al. Placental recess accompanied by a T2 dark band: a new finding for diagnosing placental invasion. Abdom Radiol (NY). 2017;42:2146–53. 16. Schwartz LW, Panicek DM, Berk AR, et al. Improving communication of diagnostic radiology findings through structured reporting. Radiology. 2011;260:174–81. 17. Familiari A, Liberati M, Lim P, et al. Diagnostic accuracy of magnetic resonance imaging in detecting the severity of abnormal invasive placenta: a systematic review and meta-analysis. Acta Obstet Gynecol Scand. 2018;97:507–20. 1. Departamento de Diagnóstico por Imagem da Escola Paulista de Medicina da Universidade Federal de São Paulo (EPM-Unifesp), São Paulo, SP, Brasil 2. Departamento de Anatomia e Imagem da Faculdade de Medicina da Universidade Federal de Minas Gerais (UFMG), Belo Horizonte, MG, Brasil 3. Grupo Fleury, São Paulo, SP, Brasil 4. Hospital São Luiz, São Paulo, SP, Brasil a. https://orcid.org/0000-0002-9222-0005 b. https://orcid.org/0000-0003-2189-048X c. https://orcid.org/0000-0001-8304-6677 d. https://orcid.org/0000-0002-1911-9090 e. https://orcid.org/0000-0002-6556-7003 f. https://orcid.org/0000-0002-2701-1928 Correspondência: Dra. Thais Coura Figueiredo Agostini Departamento de Diagnóstico por Imagem – EPM-Unifesp Rua Napoleão de Barros, 800, Vila Clementino São Paulo, SP, Brasil, 04024-002 E-mail: thaiscfigueiredo87@gmail.com Recebido para publicação em 14/3/2019 Aceito, após revisão em 5/8/2019 |
|
Av. Paulista, 37 - 7° andar - Conj. 71 - CEP 01311-902 - São Paulo - SP - Brazil - Phone: (11) 3372-4544 - Fax: (11) 3372-4554